Лечебный патоморфоз при раке предстательной железы



Рак простаты (РП) занимает второе место среди злокачественных новообразований у мужчин. В последние годы отмечается быстрый рост заболеваемости РП. В России в 2000 году состояло на учете у онкологов 37 442 больных РП, а в 2010 году – 107 942 пациента, прирост составил 155 % [1]. Несмотря на улучшение методов диагностики и внедрение ПСА-мониторинга, заболеваемость запущенными формами РП в России остается на высоком уровне. В последние десятилетия эффективность лечения онкологических больных по показателям длительной выживаемости и продолжительности жизни изменяется незначительно [2]. Лечебный патоморфоз — это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения. Неоспоримым методом оценки степени развития лечебного патоморфоза после воздействия на ткань простаты является гистологическое и иммуногистохимическое исследование [3,4]. Однако для разных методов лечения рака простаты характерны свои особенности морфологических и иммуногистохимических изменений.
Цель: изучение степени выраженности патоморфоза аденокарциномы простаты через 3 месяца после максимальной андрогенной блокады (МАБ).
Материалы и методы
В данной работе мы изучали материал, полученный от 30 пациентов с диагнозом ацинарная аденокарцинома простаты до и после лечения МАБ. До лечения исследовали материал трансректальной биопсии простаты, после – материал трансуретральной резекции простаты. Признаки патоморфоза РП оценивали через 3 месяца после билатеральной орхэктомии или химической кастрации (20 пациентов – после билатеральной орхэктомии, 10 пациентов – после 3 месяцев непрерывного приема элегарда). Материал после фиксации, стандартной проводки и парафинизации окрашивали гематоксилином и эозином. Изучали морфологические изменения не только в аденокарциноме, но и в железах простаты. Иммуногистохимические реакции проводили на парафиновых срезах, используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675) фирмы Daco, в качестве хромогена – диаминобензидин (Daсo). В работе использовали следующие антитела: Monoclonal Mouse Anti-Human Androgen Receptor Clone AR 441-фирма Daco (разведение 1:50); P53 Mouse Monoclonal Antibody- фирма CELL MARQUE (разведение 1:100); Monoclonal Mouse Anti-Human Ki67 Antigen Clone MIB-1-фирма Daco (разведение 1:100); AMACR Rabbit Polyclonal Antibody RP 134 R -фирма Diagnoatic BioSystems (разведение 1: 50); Monoclonal Mouse anti Bcl-2 oncoprotein-фирма Daco (разведение 1:50). Результаты реакций цитоплазматических маркеров (AMACR, Вcl2) оценивали полуколичественным способом по балльной шкале от 0 до 3 с помощью светового бинокулярного микроскопа «MicrosMC100», учитывая выраженность реакции и ее локализацию: 0 – отсутствие экспрессии, 1 – слабая экспрессия, 2 – умеренная экспрессия, 3 – сильная экспрессия маркера. Результаты экспрессии с ядерными антигенами (Р53, Andr) оценивали, подсчитывая количество окрашенных ядер на 100 ядер в 5 полях зрения, выражая полученные результаты в процентах. Результаты реакций оценивали по системе подсчета histochemical score (Hs). Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-х балkьной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
Формула подсчета следующая: histochemicalscore (Hs) = ∑ P (i) х i,
где i – интенсивность окрашивания, выраженная в баллах от 0 до 3. P (i) – процент клеток, окрашенных с разной интенсивностью. Для определения индекса пролиферации экспрессии ядерного маркера Ki67 выполняли подсчет количества окрашенных ядер клеток опухоли, учитывая процентное соотношение окрашенных/неокрашенных ядер клеток на 100 учтенных клеток в 10-ти репрезентативных полях зрения при увеличении х40. Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows, критерия Манна – Уитни.
Результаты исследования и их обсуждение
В биоптатах простаты, до лечения у всех 30 пациентов была диагностирована ацинарная форма аденокарциномы 3+4=7 или 4+4=8 балов по Глисону, занимающая в среднем 40–60 % биоптата. Кроме участков аденокарциномы, у всех пациентов диагностировались признаки доброкачественной гиперплазии простаты (смешанный вариант) с простатической интраэпителиальной неоплазией (ПИН) высокой степени. Через 3–3,5 месяца после лечения МАБ при морфологическом изучении материала с помощью обзорных методов окраски, у всех пациентов (как после билатеральной орхэктомии, так и химической кастрации) в аденокарциноме развивались следующие изменения: в цитоплазме опухолевых клеток – дистрофические изменения. Ядра становились более мелкими, гиперхромными, ядрышки не визуализировались. После лечения у 70 % пациентов увеличивалась градация по Глисону, так как на некоторых участках опухоль теряла свое ацинарное строение, начинали преобладать участки солидного строения из мелких опухолевых клеток. Описанные изменения, развивающиеся в простате в первые месяцы после МАБ, отмечают и другие авторы [5]. В строме простаты у 98 % пациентов появлялась очаговая лимфоцитарная инфильтрация и полнокровие сосудов. Морфологические изменения в простате у пациентов после билатеральной орхэктомии и химической кастрации были одинаковые.
По данным литературы [6], опухолевый маркер Ki-67 является одним из наиболее востребованных в онкологии для морфологического определения пролиферативной активности опухолевых клеток, степени злокачественности новообразования и решения вопроса о виде дополнительного консервативного лечения в адъювантном и/или неоадъювантном режимах. Для достоверной оценки данного маркера изучали его экспрессию как до, так и после МАБ. До лечения индекс пролиферации опухолевых клеток был во всех случаях на достаточно высоком уровне и колебался от 40 % до 89 % (медиана 60 %). После МАБ (как билатеральной орхэктомии, так и химической кастрации) показатели индекса пролиферации заметно снижались и находились в пределах от 0 % до 25 % (медиана15 %). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия. Экспрессия данного маркера в ядрах эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) также снижалась: до МАБ медиана – 40 %, после – 1,5 %, однако по критерию Манна – Уитни различия в данных выборах были не существенны.
Альфа-метилацил-КоА-рацемаза (AMACR) – специфичный высокоэффективный иммуногистохимический онкомаркер, позволяющий дифференцировать рак простаты от других патологических процессов, а также более точно определить стадию заболевания. Этот маркер считается позитивным в 80–100 % случаев малых очагов рака [7]. В нашем исследовании до лечения у 96 % пациентов в аденокарциноме простаты отмечали сильную (3 балла) экспрессию данного маркера в виде мелких зерен коричневого цвета в цитоплазме, у 4 % пациентов – умеренную. После лечения у 56,5 % пациентов экспрессия данного маркера была слабая (1 балл), у 37,5 % – умеренная (2 балла), и лишь у 6 % пациентов экспрессия оставалась на высоком уровне (3 балла). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия в уровнях выборок. Экспрессия AMACR находилась в прямой корреляции с маркером пролиферации Ki-67. Экспрессия данного маркера в цитоплазме эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) также снижалась, однако по критерию Манна – Уитни различия в выборах до и после лечения были не существенны. Стромальная экспрессия данного маркера была минимальна как до, так и после МАБ.
Р53 иммуногистохимический маркер, локализующийся в ядре клетки, является супрессором опухолевого роста. Он предотвращает вступление клетки с поврежденной ДНК в фазу цикла и индуцирует апоптоз. Мутация гена р53 ведет к потере контроля пролиферации клеток, угнетению апоптоза. Утрата функции этого гена может быть связана с высоким метастатическим потенциалом опухоли и развитием андрогеннезависимого РП. Величина экспрессии мутированного р53 при РП зависит от того, состоит ли она из гормонозависимых клеток или образована гормононезависимыми клетками [7]. Однако другие авторы считают, что взаимосвязь между экспрессией маркера p53 и прогнозом при РП требует дальнейшего изучения [8]. В нашем исследовании мы учитывали экспрессию данного маркера в ядрах эпителия желез и в элементах опухоли. У пациентов до лечения МАБ в аденокарциноме простаты экспрессия данного маркера колебалась в пределах Hs= от 200 до 70 (медиана 130). После МАБ показатели экспрессии снижались: медиана Hs=60, но интервал колебания экспрессии данного показателя составлял от Hs=15 до 250. Сравнивая показатели групп по критерию Манна – Уитни, мы получили, что различия в уровнях выборок были не существенными. В ядрах эпителия простатических желез экспрессия Р53 до МАБ составляла Hs= от 70 до 0 (медиана 50), после лечения МАБ Hs= от 20 до 0 (медиана 5). По критерию Манна – Уитни различия в уровнях выборок были не существенными.
Антиген Всl-2 экспрессируется в цитоплазме и на базальной мембране эпителия желез и является регулятором апоптоза. В андрогеннезависимом РП отмечается усиленная экспрессия гена Bcl-2, что является признаком гормоноустойчивости [9]. Ген Вс1-2 способствует опухолевой прогрессии, ингибируя апоптоз и тем самым повышая выживаемость опухолевых клеток [10]. В нашем исследовании экспрессия данного маркера в клетках аденокарциномы у пациентов до МАБ была умеренной (2 балла) и сильной (3 балла) во всех случаях. После лечения у 12 % пациентов экспрессия оставалась сильной, у 41 % пациентов отмечали умеренную экспрессию, у 35 % – слабую, и у 12 % экспрессия данного маркера в опухолевых клетках была отрицательной. Используя критерий Манна – Уитни, можно считать, что различия в уровнях выборок являются существенными. У 93 % пациентов после МАБ положительная экспрессия Вс1-2 в лимфоцитах в очагах лимфоцитарной инфильтрации в строме простаты. Экспрессия данного маркера в цитоплазме эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) снижалась, но по критерию Манна – Уитни различия в выборах до и после лечения были не существенны.
Медицинские интернет-конференции
Кирякевич Л.О
Научный руководитель: к.м.н., доцент Воронина Е.С
Лечебный патоморфоз аденокарциномы простаты
Рак простаты – одно из самых распространенных онкологических заболеваний среди мужского населения большинства развитых стран мира.
Лечебный патоморфоз — это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения. Неоспоримым методом оценки степени развития лечебного патоморфоза после воздействия на ткань простаты является гистологическое и иммуногистохимическое исследование.
В настоящее время одними из наиболее частых методов лечения рака простаты являются сфокусированная ультразвуковая аблация (HiFu), максимальная андрогенная блокада (МАБ).
После HiFu терапии в гистологических препаратах преобладают склеротические изменения с фрагментами железистой ткани.
Иммуногистохимическое исследование после лечения показало снижение маркера AMACR (маркер злокачественной трансформации клеток), снижение PCNA (маркер пролиферации), небольшое увеличение экспрессии Bcl-2 (регулятор апоптоза), маркер рецепторов к андрогенам оставался не прежнем уровне.
МАБ проводится с помощью орхэктомии и химической кастрации.
При оценке лечебного патоморфоза после МАБ отмечаются следующие изменения: в цитоплазме дистрофические изменения; ядра мелкие, гиперхромные. Некоторые участки опухоли теряют свое ацинарное строение.
При ИГХ-исследовании отмечается заметное снижения экспрессии маркера пролиферации, снижение экспрессии АMACR и P-53 (маркер регуляции клеточного цикла).
Таким образом при оценке лечебного патоморфоза после Hi-Fu-терапии с использованием стандартной окраски эозином гематоксилином наблюдается выраженный положительный результат (3 степень лечебного паморфоза), что подтверждается ИГХ-исследованием.
Для оценки лечебного патоморфоза после МАБ необходимо ИГХ-исследование, так как стандартная окраска не позволяет достоверно оценить степень патоморфоза.
Лечебный патоморфоз при раке предстательной железы
Вопрос о структуре самого лечебного патоморфоза болезни продолжает оставаться дискуссионным. Как известно, этиология н патогенез подавляющего большинства опухолевых болезней точно не установлены, а потому эти элементы не могут служить достоверными показателями патоморфоза. Наиболее значимыми являются изменения клинических и морфологических проявлений болезни.
Именно эти изменения входят в число существенных признаков, раскрывающих содержание понятия. В разряд патоморфоза следует отнести изменчивость н другие элементы болезни, в частности, ее осложнения, неходы н непосредственные причины смерти.
Часто возникает вопрос о том, все ли изменения болезни и опухоли можно отнести к патоморфозу. Отвечая на этот вопрос, следует заметить, что к патоморфозу могут быть отнесены лишь типовые и стойкие изменения болезни (опухоли) Я. Л. Раппопорт (1962) подчеркивал, что нозоморфоз — это не эксцесс, выходящий за рамки клинико-анатомических вариаций, свойственных данной опухоли. Нозоморфоз представляет собой типичное для данной опухоли (либо для данного метода лечения) явление.
Следует при этом, однако, помнить, что «типичное», «стандартное» для опухоли весьма относительно, как относительна и сама клиническая и морфологическая характеристика патоморфоза. Вместе с тем патоморфоз — это не беспорядоч ное н хаотичное изменение. Изучение проявлений и механизмов патоморфоза позволяет выделить его общую и главную черту — перестройку закономерностей происхождения и развития болезни (родовое понятие) на уровне вида, популяции и индивидуума (видовое отличие).
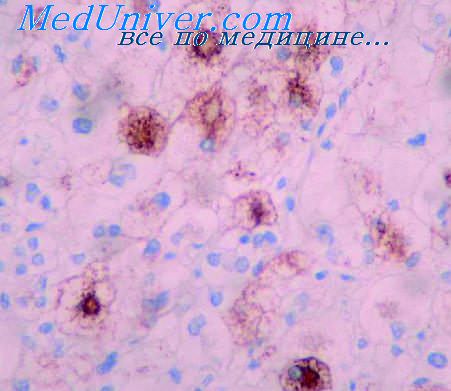
Иными словами, в понятие «патоморфоз» входят типичные явления, повторяющиеся существенные отношения, отражающие определенные и во многом пока еще не установленные закономерности возникновения, развития и проявления опухолевого процесса.
Следует отметить, что по мере усовершенствования лучевых методов лечения и увеличения числа лекарственных средств с усилением их лечебных свойств при химиотерапии возрос не только лечебный потенциал врача-онколога, но также возросло и количество повреждений различных органов и тканей. Ятрогенные патологические процессы не только изменяют клинико-анатомические проявления опухолевой болезни, но и могут быть непосредственной причиной смерти. Однако разнообразные неблагоприятные реакции на медикаментозные средства, а также осложнения, вызванные хирургическими и терапевтическими вмешательствами, в проявление патоморфоза включать не следует.
Установление патоморфоза опухолевых болезней представляет интерес с точки зрения практики и теории медицины. Данные о патоморфозе опухолей используют на практике для сравнения разных методов лечения, для оценки эфектквкости проводимого (или уже законченного) лечения для объективного обоснования прогноза и его критериев, для оптимизации сроков диспансерного наблюдения и экспертизы трудоспособности, а также для других целей. Наблюдения патоморфоза в клинике одновременно являются основой для теоретических разработок в различных областях онкологии, патологии, радиобиологии и т. д.
Сюда можно отнести разработку принципов лечения злокачественных новообразований, изучение сущности биологического действия ионизирующих излучений, взаимоотношения опухоли и организма в условиях лечения, восстановления повреждений нуклеиновых кислот и клеточных органелл и т. д.
В качестве примера важности изучения лечебного патоморфоза опухолей достаточно привести данные ВОЗ (Женева, 1982) из доклада «Оптимизация лучевой терапии». Различия в характере используемых методов противораковой терапии свидетельствуют о том, что даже в развитых странах еще не удалось добиться повсеместной оптимизации ее программ. Около одной трети всех больных раком нуждаются в лучевой терапии либо отдельно, либо в сочетании с хирургическим лечением, тогда как потребность в хирургическом лечении отдельно или в сочетании с другими методами выявляется в половине случаев заболевания раком.
Менее одной десятой всех больных раком подвергаются химиотерапии, гормонотерапии и другим видам лечения, а около четверти всех больных либо не получают специфического лечения, либо находятся на слишком поздних стадиях заболевания для применения соответствующих методов лечения. Следовательно, знание особенностей патоморфоза болезни и патоморфоза опухоли необходимо для оптимизации лечения. Решение этой проблемы требует решения многих частных вопросов, например, определяет ли гистологическое строение опухоли ее чувствительность к лечебному фактору (излучению, хнмиопрепарату, гормону и т. д.). В широком плане вопрос должен решаться в рамках проблемы взаимоотношения общего и частного с тем, чтобы не уклониться в морфологизм, функционализм и другие крайности.
В зависимости от клинической ситуации и цели исследования для выявления и оценки патоморфоза можно использовать любые доступные методы и подходы клинические, морфологические, радиологические, рентгено логические, биохимические и др. Неуклонно возрастает роль цитологических исследований в оценке патоморфоза. Каждый метод используемся либо самостоятельно, либо в комплексе. Объектом морфологического исследования может быть биопсийныи, операционный и секционный материал. Морфологическое исследование леченых опухолей не отличается от общих правил обработки онкологического материала.
Следует лишь подчеркнуть 3 момента. Во-первых, на всех этапах исследования должно руководствоваться клинико-анатомическнм принципом, который подразумевает тесный контакт патологоанатома и клинициста на практике и в познании. Приступая к исследованию материала, патологоанатом должен располагать необходимыми клиническими сведениями о больном, о цели и об особенностях проведенного лечения (метод лечения, доза облучения или химиопрепарата, вид и сроки оперативного лечения и т. п. ). Без данных о характере лечения производить оценку патоморфоза не рекомендуется ввиду возможных ошибок и дискредитации морфологического метода и самого исследования.
Во-вторых, максимального внимания заслуживают те случаи, в которых после лечения визуально опухоли не находят. При предоперационной лучевой и/или химиотерапии с видимым исчезновением опухоли операционный материал приходится исследовать иногда повторно с обработкой большого числа биоптатов. Снять диагноз «рака» почти всегда бывает труднее, чем его установить. В-третьих, при оценке патоморфоза обязателен сравнительный метод. Сравнение может быть либо на уровне конкретного больного (повторные пункции опухоли и биопсии в процессе лечения, сравнение биопсийного и операционного материала и т.д.), либо на уровне группы больных одной нозологической формой (сравнение типичных проявлений болезни).
— Вернуться в оглавление раздела «гистология»
Источники: http://science-education.ru/ru/article/view?id=26608, http://medconfer.com/node/18277, http://meduniver.com/Medical/gistologia/405.html












































