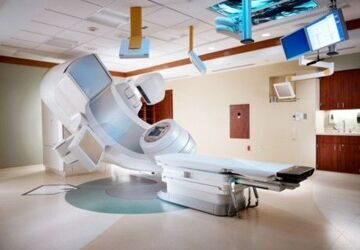
Линейный ускоритель — метод лучевой терапии
Линейный ускоритель – это радиотерапевтический комплекс, который используется для проведения облучения злокачественных новообразований. Системы визуализации и синхронизации с дыханием пациента дают возможность точного дозирования радиации в центре злокачественной опухоли. Инновационные технологии позволяют минимизировать повреждение здоровых тканей, сократить длительность лечения и значительно уменьшить время воздействия облучения.
Линейные ускорители: ощутите разницу
Чем отличается лечение на линейном ускорителе от обычной лучевой терапии? При проведении лучевого облучения на традиционных аппаратах, используется мощное гамма-излучение, которое эффективно разрушает опухоль. Существенным недостатком устаревшей технологии является неуправляемое излучение, которое поражает здоровые ткани и органы, что ведет к инвалидизации и снижению качества жизни онкобольных.
Современные линейные ускорители отличает отсутствие в них радиоактивных элементов. Облучение осуществляется узконаправленными лучами, в месте пересечения которых образуется высокая концентрация радиации на область новообразования. Также различаются способы определения формы и расположения опухоли. Инновационные технологии позволяют формировать участок облучения по форме пораженных тканей, что дает возможность использовать линейные ускорители для лечения онкологии подвижных новообразований при естественном изменении их положения.
 Высокая эффективность методики лучевой терапии доказана в ведущих онкологических центрах Европы, Израиля и России. Лечение линейным ускорителем показано в следующих случаях:
Высокая эффективность методики лучевой терапии доказана в ведущих онкологических центрах Европы, Израиля и России. Лечение линейным ускорителем показано в следующих случаях:
- новообразования молочной железы;
- злокачественные опухоли кишечника и прямой кишки;
- новообразования органов малого таза и поджелудочной железы;
- при лечении опухолей головного мозга;
- злокачественные поражения простаты;
- рак легкого;
- при лечении некоторых видов неопухолевых заболеваний.
Краткий обзор линейных медицинских ускорителей
Линейный ускоритель в медицине – настоящая панацея и дает надежду на выздоровление и улучшение качества жизни более чем 80% больным онкологией. Медико-биологические комплексы радиационной терапии отличаются надежностью и многоуровневыми системами автоматизации:
- Линейные ускорители Varian Clinac производства США в разных модификациях являются основным лечебным оборудованием в ведущих онкологических клиниках мира. На сегодняшний день линейный ускоритель clinac truebeam (True Beam) является безальтернативным по скорости и точности. Это единственная модификация линейного ускорителя, облучение которым позволяет уничтожить новообразование за один сеанс.
- Линейный ускоритель Еlekta Synergy – высокотехнологичный комплекс последнего поколения, позволяющий проводить облучение фотонами и электронами разных энергий. Укомплектован системой 3D визуализации и инновационным программным обеспечением, что помогает точно задать контуры новообразования и оптимизировать размещение пациента до начала лучевой терапии. Радиотерапевтический линейный ускоритель synergy s – это повышенная механическая прочность и точность движущихся систем установки, а также расширенные возможности системы рентгеновской визуализации.
- Линейный ускоритель Primus производства компании Siemens – наиболее технологичное оборудование с компактным дизайном. Сочетает в себе точность терапии, простоту в использовании и непревзойденную надежность. Ускорители Primus являются многофункциональным радиотерапевтическим оборудованием, что позволяет решать различные клинические задачи с учетом финансовых возможностей пациента.
Стоимость лучевой терапии
Линейный ускоритель – цена сопоставима с лечением по устаревшим технологиям. Например, стоимость курса лучевой терапии (10 – 15 процедур) на линейном ускорителе Вариан (Varian) начинается от 100 000 рублей. Цена варьируется в зависимости от объемов подготовительного этапа, стадии заболевания, локализации и формы опухоли.
Линейный ускоритель при раке простаты
Поиск и подбор лечения в России и за рубежом
ЛЕЧЕНИЕ РАКА — МЕДИЦИНСКИЙ ЛИНЕЙНЫЙ УСКОРИТЕЛЬ
Радиотерапия, лучевая терапия — лечение ионизирующей радиацией (рентгеновским, гамма-излучением, бета-излучением, нейтронным излучением, пучками элементарных частиц из медицинского ускорителя). Применяется в основном для лечения злокачественных опухолей.
Стереотаксическая радиохирургия (СРХ) — это область лучевой терапии, которая подразумевает применение высокоточного излучения.
Выделяют три основных метода проведения стереотаксических радиохирургических операций, в каждом из которых источником излучения служат те или иные приборы:
Линейный ускоритель (англ. linac — LINear ACcelerator) — устройство для создания ионизирующего излучения (рентгеновского и/или электронного) высокой проникающей способности (20 МэВ и выше).
В медицине линейные ускорители используются как основной элемент радиотерапии и радиохирургии (источник рентгеновского излучения).
МЕДИЦИНСКИЙ ЛИНЕЙНЫЙ УСКОРИТЕЛЬ ЗАРЯЖЕННЫХ ЧАСТИЦ — это устройство, которое чаще всего используется для проведения наружной радиотерапии при злокачественных новообразованиях любых тканей и органов.

Линейный ускоритель обеспечивает доставку к опухоли высокоэнергетических рентгеновских лучей. При этом повреждаются клетки новообразования, а окружающие здоровые ткани остаются в неприкосновенности.
Линейный ускоритель применяется при стандартной лучевой терапии, радиотерапии с модулированной интенсивностью, радиотерапии под визуальным контролем, стереотаксических радиохирургических вмешательствах и экстракраниальной стереотаксической радиотерапии.
ПРИНЦИП РАБОТЫ МЕДИЦИНСКОГО ЛИНЕЙНОГО УСКОРИТЕЛЯ
В основе работы линейного ускорителя лежат микроволновые технологии, подобные принципам действия радара.
В волноводной системе линейного ускорителя происходит разгон (ускорение) электронов, которые затем сталкиваются с препятствием из тяжелого металла, что сопровождается выработкой высокоэнергетического рентгеновского излучения. На выходе из линейного ускорителя форма полученного пучка лучей подстраивается под параметры опухолевого очага, что обеспечивает его точное облучение.
Изменение формы пучка происходит с помощью многолепесткового коллиматора, встроенного в ускоритель, или специальных блоков, которые укрепляются на аппарате извне.
Во время лечения пациент располагается на подвижной кушетке, а положение его тела оценивается с помощью лазерной системы. Кушетка может перемещаться в разных направлениях: вверх, вниз, вправо, влево, вперед и назад.
Пучки лучей выходят из устройства под названием гентри, которое вращается вокруг кушетки.
Перемещения стола пациента и вращение гентри вокруг него обеспечивают возможность доставки излучения к опухоли под самыми разными углами.
Объем необходимого радиотерапевтического вмешательства и дозу излучения определяет лечащий онколог-радиолог.
Способ доставки назначенной дозы, а также расчет времени, которое для этого требуется линейному ускорителю, выбирает медицинский физик и дозиметрист.
Непосредственный сеанс радиотерапии проводит врач-радиолог, который и управляет линейным ускорителем.
ПРОЦЕДУРА ЛЕЧЕНИЯ С ПОМОЩЬЮ ЛИНЕЙНОГО УСКОРИТЕЛЯ

Безопасность пациента является одним из важнейших приоритетов при проведении радиотерапии. Она обеспечивается за счет следующих моментов.
Перед началом лечения осуществляется разработка плана лучевой терапии, который должен получить одобрение со стороны онколога-радиолога, медицинского физика и дозиметриста.
Разработанный план проходит двойной контроль качества, что позволяет убедиться в его соответствии заявленным требованиям по лечению.
Крайне важен контроль работы линейного ускорителя. Для этого в аппаратуру встраивается несколько контролирующих систем, что не позволяет превысить дозу, назначенную онкологом-радиологом.
Перед началом каждого сеанса радиолог или техник-радиолог с помощью специального устройства проверяет точность работы линейного ускорителя и оценивает равномерность излучения по ходу всего пучка.
Более подробная проверка оборудования проводится еженедельно и ежемесячно.
Современные линейные ускорители снабжены встроенными системами контроля, которые обеспечивают дополнительную безопасность. При этом оборудование нельзя включить до того момента, пока не будут достигнуты все требования к параметрам лечения, назначенные врачом.
В течение всего сеанса врач непрерывно наблюдает за пациентом с помощью телевизионной системы.
Процедурный кабинет оснащен микрофоном, с помощью которого пациент при необходимости может общаться с медицинским персоналом.
Во время сеанса проводится регулярная рентгеновская съемка, что позволяет убедиться в отсутствии отклонений параметров пучка лучей от ранее заданных.
Кроме безопасности пациента, работа линейного ускорителя не должна приносить вред и медицинскому персоналу. Оборудование для проведения радиотерапии обычно располагается в кабинетах, экранированных свинцовыми и бетонными стенами, которые непроницаемы для рентгеновских лучей. При этом включение линейного ускорителя врачом производится извне процедурного кабинета.
Поскольку ускоритель генерирует излучение только во включенном состоянии, риск непреднамеренного облучения крайне невелик. Прекрасная защита операторского пульта позволяет работать с линейным ускорителем даже беременным женщинам.
+7 495 66 44 315 — где и как вылечить рак
Сегодня в Израиле рак молочной железы поддается полному излечению. По данным израильского министерства здравоохранения, в настоящее время в Израиле достигнута 95% выживаемость при данном заболевании. Это — самый высокий показатель в мире. Для сравнения: по данным Национального Канцер Регистра заболеваемость в России в 2000г по сравнению с 1980г увеличилась на 72%, а выживаемость составляет 50%.
На сегодняшний день стандартом лечения клинически локализованного рака предстательной железы (т.е. ограниченного на простате), а значит излечимого, считается либо различные оперативные методы, либо лучевые терапевтические методы (брахитерапия). Стоимость диагностики и лечения рака предстательной железы в Германии составит от 15.000 € до 17.000 €
Данный вид оперативного лечения был разработан американским хирургом Фредериком Мосом и успешно применяется в Израиле на протяжении последних 20 лет. Определение и критерии операции по методу Моса разработаны Американским колледжем операции Моса (ACMS) совместно с Американской академией дерматологии (AAD).
- Рак молочной железы
- Онкогинекология
- Рак легких
- Рак предстательной железы
- Рак мочевого пузыря
- Рак почки
- Рак пищевода
- Рак желудка
- Рак печени
- Рак поджелудочной железы
- Колоректальный рак
- Рак щитовидной железы
- Рак кожи
- Рак костей
- Опухоли мозга
- Лечение рака Кибер-ножом
- Нано-нож в лечении рака
- Лечение рака Протонной терапией
- Лечение рака в Израиле
- Лечение рака в Германии
- Радиология в лечении рака
- Радиология — Диагностическая радиология
- Радиодиагностика – МРТ
- МРТ головы и головного мозга
- Проведение процедуры МРТ головы и головного мозга
- МРТ позвоночника и спинного мозга
- Проведение процедуры МРТ позвоночника и спинного мозга
- МРТ костно-мышечной системы
- Проведение процедуры МРТ костно-мышечной системы
- МРТ тела
- Проведение процедуры МРТ тела
- МРТ органов грудной клетки
- Проведение процедуры МРТ органов грудной клетки
- Магнитно-резонансная холангиопанкреатография (МРХПГ)
- Проведение процедуры МРХПГ
- МРТ молочных желёз
- Проведение процедуры МРТ молочных желёз
- Биопсия
- Проведение процедуры биопсии
- Биопсия молочных желёз под контролем МРТ
- Проведение процедуры биопсии молочных желёз под контролем МРТ
- Биопсия – Пункционная биопсия при узловых образованиях в лёгких
- Проведение процедуры пункционной биопсии при узловых образованиях в лёгких
- Люмбальная пункция
- Проведение процедуры люмбальной пункции
- Радиодиагностика — Ультразвуковое исследование (УЗИ)
- УЗИ костно-мышечной системы
- Проведение процедуры УЗИ костно-мышечной системы
- УЗИ органов малого таза
- Проведение процедуры УЗИ органов малого таза
- УЗИ простаты
- Проведение процедуры УЗИ простаты
- УЗИ молочных желез
- Проведение процедуры УЗИ молочных желез
- Биопсия молочных желез под контролем УЗИ
- Проведение процедуры биопсии молочных желез под контролем УЗИ
- Маммография
- Проведение процедуры маммографии
- Стереотаксическая биопсия молочных желёз
- Проведение процедуры стереотаксической биопсии молочных желёз
- Радиодиагностика — Рентгенологичекое исследование
- Рентгенография костей
- Проведение процедуры рентгенографии костей
- Рентгенография органов грудной клетки
- Проведение процедуры рентгенографии органов грудной клетки
- Рентгенография верхних отделов ЖКТ
- Проведение процедуры рентгенографии верхних отделов ЖКТ
- Рентгенография нижних отделов ЖКТ
- Проведение процедуры рентгенографии нижних отделов ЖКТ
- Миелография
- Проведение процедуры миелографии
- Гистеросальпингография
- Проведение процедуры гистеросальпингографии
- Радиология — Лечебная радиология
- Катетерная эмболизация
- Проведение процедуры катетерной эмболизации
- Радиоэмболизация
- Проведение процедуры радиоэмболизации
- Химиоэмболизация
- Проведение процедуры химиоэмболизации
- Криотерапия
- Проведение процедуры криотерапии
- Вмешательства на сосудах головного мозга
- Проведение процедуры вмешательства на сосудах головного мозга
- Вмешательства на органах грудной клетки
- Проведение процедуры вмешательства на органах грудной клетки
- Вмешательства на желчевыводящих путях
- Проведение процедуры вмешательства на желчевыводящих путях
- Лечение рака — Медицинский линейный ускоритель
- Лечение рака — Система Гамма-нож
- Лечение рака — Протонная терапия
- Проведение процедуры протонной терапии
- Радиотерапия – Наружная лучевая терапия
- Проведение процедуры наружной лучевой терапии
- Радиотерапия – Внутренняя лучевая терапия (Брахитерапия)
- Проведение процедуры внутренней лучевой терапии (Брахитерапии)
- Радиотерапия – Стереотаксическая радиохирургия (СРХ)
- Проведение процедуры стереотаксической радиохирургии (СРХ)
- Радиотерапия под визуальным контролем (РТВК)
- Проведение процедуры радиотерапии под визуальным контролем (РТВК)
- Радиотерапия с модулированной интенсивностью (РТМИ)
- Проведение процедуры РТМИ
- Радиоиммунотерапия (РИТ)
- Проведение процедуры радиоиммунотерапии (РИТ)
- Радиотерапия опухолей головного мозга
- Проведение процедуры радиотерапии головного мозга
- Радиотерапия злокачественных опухолей органов головы и шеи
- Проведение процедуры радиотерапии злокачественных опухолей органов головы и шеи
- Радиотерапия рака лёгких
- Проведение процедуры радиотерапии рака лёгких
- Радиотерапия рака молочной железы
- Проведение процедуры радиотерапии рака молочной железы
- Израиль – Метод SIRT-терапии
- Израиль – Программа радиоэмболизации рака печени по технологии SIRT
- Израиль – Специалисты по радиотерапии и радиохирургии
- Германия – Институт радиологии и ядерной медицины Мюнхенского Кардиоцентра
- Германия — Центр протонной терапии Ринекера в Мюнхене
- Германия – Центр CYBERKNIFE (Кибернож) в Мюнхене
- Германия – Радиологическое отделение клиники Нордвест во Франкфурте-на-Майне
- Рак крови
- Полное обследование организма — Москва
Лечение рака Нано-ножом
Нано-Нож (Nano-Knife) — новейшая технология радикального лечения рака поджелудочной железы, печени, почек, легких, простаты, метастазов и рецидивов рака. Нано-Нож убивает опухоль мягких тканей электрическим током, сводя к минимуму риск повреждения близлежащих органов или кровеносных сосудов.

Лечение рака Кибер-ножом
Технология Кибер-Нож была разработана группой врачей, физиков и инженеров Стендфордского Университета. Эта методика была одобрена FDA лечения внутричерепных опухолей в августе 1999 года, и для опухолей в остальных областях тела в августе 2001 года. На начало 2011г. действовали около 250 установок. Система активно распространяется по всему миру.
Лечение рака Протонной терапией
ПРОТОННАЯ ТЕРАПИЯ — радиохирургия протонного пучка или тяжело заряженных частиц. Свободно двигающиеся протоны извлекают из атомов водорода. Для этого служит специальный аппарат, который отделяет отрицательно заряженные электроны. Оставшиеся положительно заряженные частицы и есть протоны. В ускорителе частиц (циклотроне) протоны в сильном электромагнитном поле разгоняются по спиральной траектории до огромной скорости, равной 60% скорости света — 180 000км/сек.
Лучевая терапия рака предстательной железы
Глава 8. Лучевая терапия рака предстательной железы
Лучевая терапия является в настоящее время одним из ведущих консервативных специальных методов лечения рака предстательной железы как при локализованном, так и при местнораспространенном процессе.
Дистанционное облучение с применением мегавольтных источников излучения (гамма-установка, линейные ускорители и др.) рекомендуется сейчас при всех стадиях рака предстательной железы (Алиев Б.М., 1983, Свиридова Т.В., 1994, Amin P.P. et al. 1983, Bagschow М.A., 1983 и др.). Оно является альтернативой радикальной простатэктомии в начальной стадии заболевания, в случае невозможности операции в связи с сопутствующими заболеваниями или отказом больного от оперативного лечения. Лучевая терапия с успехом применяется как в случаях локализованного, так и местнораспространенного рака предстательной железы.
При этом в подходах к лучевому лечению у различных авторов имеются существенные различия, касающиеся техники и технологии облучения, объема лучевого воздействия и суммарных очаговых доз.
Противопоказаниями к проведению лучевой терапии считаются: общее тяжелое состояние больного, раковая кахексия, выраженный цистит и пиелонефрит, наличие большого количества остаточной мочи, хроническая почечная недостаточность, азотемия (Голдобенко Г.В., 1997).
Последнее десятилетие ознаменовалось значительным прогрессом в изучении возможностей лучевой терапии рака предстательной железы. Арсенал средств и методов лечения обогатился новыми подходами к лучевому лечению, ряд которых оказался весьма плодотворным. Популярность ее объясняется рядом очевидных преимуществ перед другими известными терапевтическими методами. Лучевая терапия не оказывает пагубного влияния на сердечно-сосудистую и свертывающую системы крови, изменения которых под воздействием гормонотерапии нередко приводят к преждевременным летальным исходам. В последние годы некоторыми исследователями, даже при ранних стадиях заболевания, лучевой терапии отдается предпочтение перед хирургическим лечением (радикальной простатэктомией), так как отдаленные результаты обоих методов приблизительно одинаковы, но облучение не вызывает столь серьезных лечебных последствий, как хирургическое лечение: 0.5-5% — послеоперационной летальности, 95-100% — импотенции, 10-15% — недержание мочи и пр.
Некоторые литературные данные о выживаемости больных раком предстательной железы, леченных лучевым методом представлены в табл. 34.
Таблица 34. Результаты лучевой терапии рака предстательной железы. Выживаемость за 5 и 10 лет.
Эффективность радиотерапии больных раком предстательной железы во многом зависит от качества планирования облучения. Планированию лучевой терапии и ее клинико-дозиметрическому обоснованию обычно предшествует топометрическая подготовка больных. С этой целью широко применяются такие виды рентгенологического исследования как компьютерная томография, магнитно-ядерный резонанс и др.
В последние годы для оптимизации лучевой терапии широко применяются компьютерные программы и специальные устройства, так называемое конформальное (conformal) облучение, которые позволяют с учетом гетерогенности тканей и кривизны облучаемого участка в трех проекциях выбрать наиболее рациональные условия лучевого воздействия. В качестве критериев при этом выбрана лучевая нагрузка на наружные подвздошные и обтурационные лимфатические узлы, кожу передней и задней поверхности тела больного, тазобедренный сустав. Характер распределения доз определяют во фронтальной, сагиттальной и горизонтальной плоскостях облучаемого участка тела пациента. При оценке полученных данных исходят из того, что первичная опухоль и зоны регионарного метастазирования должны облучаться равномерно с допустимым градиентом дозы 90-100%, а лучевая нагрузка на тазобедренный сустав, заднюю стенку прямой кишки и на уровне кожных покровов не должна превышать их толерантность.
На основании полученной топометрической информации проводят тщательный анализ распределения доз при различных вариантах дистанционной гамма-терапии. Общим выводом из этих исследований явилось признание рациональности использования при локализованных формах рака предстательной железы подвижных методик дистанционной гамма-терапии, т.е. облучение только первичной опухоли; при распространенности опухоли на регионарные лимфатические узлы — сочетание вариантов подвижного и статического 4-х польного перекрестного облучения с соотношением доз с передних и задних полей 2:1. Показано, что при использовании этих вариантов облучения, лучевая нагрузка на заднюю стенку прямой кишки снижается почти на 20%, на кожные покровы ягодичной области — на 20-30% по сравнению с гамма-терапией с соотношением доз 1:1 и с однозонным подвижным облучением первичной опухоли с углом качания 240° или же двухзонным облучением с углом качания 180°. Лучевая нагрузка на уровне кожных покровов лобковой зоны с соотношением доз 2:1 находится на том же уровне, что и при старых вариантах гамма-терапии с соотношением доз 1:1, составляя 60% от величины очаговой дозы облучения.
На основе комплексного обследования, тщательной дозиметрической подготовки, а также в зависимости от распространенности опухолевого процecca, выделяют следующие варианты дистанционной лучевой терапии рака предстательной железы.
1. Облучение только первичной опухоли. В зависимости от размеров новообразования, распространения его на соседние органы и тканевые структуры, применяется одно- или двухзонная подвижная дистанционная гамма-терапия с требуемыми разведениями осей ротации, углами вращения 90°-120°. При инфильтрации одной или двух боковых стенок таза используется методика двухзонной ротации с углами качания 60°-90°. Размер поля на оси ротации, в зависимости от параметров опухоли, колеблется от 4 х 8 до 9 х 11 см. При этом в зону облучения включается первичная опухоль, шейка мочевого пузыря, передняя стенка прямой кишки с постепенным снижением поглощенных доз в направлении задней ее стенки, а также к тазобедренному суставу, до уровня ниже их толерантности. В зависимости от величины и конфигурации предстательной железы, изменяются размеры полей облучения, сектор качания и расстояние между осями качания в условиях двухзонного подвижного облучения. Если одна из долей железы увеличена, а другая имеет небольшие размеры, необходимо со стороны большего поражения железы увеличить только одно поле облучения. Разовая доза 1,8-2 Гр, суммарная — 65-70 Гр. Перерыв на дозе 30-40 Гр и продолжение облучения через 2-3 недели. Показания: ранние стадии заболевания — T1-2N0M0.
2. Облучение первичной опухоли и регионарных лимфатических узлов таза. Дистанционная гамма-терапия проводится с 4-х статических полей под углом 45° — два поля спереди, два сзади, с соотношением лучевой нагрузки с передних и задних полей 2:1. Для охвата опухоли и путей регионарного метастазирования 90-100% изодозой нижний край поля облучения располагается на уровне ануса, верхний — на уровне первого крестцового позвонка — места перехода внутренней и наружной цепочек лимфатических коллекторов в общую. Наружная граница поля проходит по линии, пересекающей внутренний край вертлужной впадины. После суммарной очаговой дозы 45 Гр поля уменьшаются в размерах и облучение проводится только на первичную опухоль одно- или двухзонной секторной ротацией до общей дозы 65-70 Гр. Углы качания варьируют при однозонной ротации от 90° до 120°, при двухзонной — от 60° до 90°. Облучение осуществляется в дозе 20-25 Гр (РОД 1,8-2 Гр) после перерыва в 2-3 недели. Показания: больные раком предстательной железы в стадии заболевания — T1-2N1-3M0, T3-4N0-x М0. При Т1-2NxM0 — суммарная доза на регионарные лимфатические узлы может быть ограничена дозой 45 Гр, на предстательную железу доза доводится до 65-70 Гр. При наличии метастатического поражения лимфатических узлов, общая суммарная доза на них доводится до 50-60 Гр.
3. Облучение первичной опухоли и лимфатических узлов таза с включением парааортальной и общей подвздошной групп лимфатических коллекторов. Лучевая терапия при этом проводится на фоне приема гормональных препаратов. Сначала облучению подвергается первичная опухоль и регионарные лимфатические узлы до общей очаговой дозы 40-45 Гр. На втором этапе расщепленного курса, после перерыва 2-3 недели, подключается облучение общих подвздошных и парааортальных лимфатических узлов с двух-фигурных полей, имеющих форму перевернутой буквы «U» с экранированием спинного мозга и почек до суммарной очаговой дозы 40 Гр. Затем продолжается облучение первичной опухоли суженными полями подвижным методом до общей очаговой дозы 65-70 Гр при значении разовой дозы 1.8-2 Гр. Показания: распространение опухоли на юкстарегионарные лимфатические узлы — Т1-4N2-3M0.
Больший объем тканей облучают на первом этапе лучевого лечения. Разовую очаговую дозу 1.8-2 Гр подводят ежедневно 5 раз в неделю. Суммарная очаговая доза достигает 45-50 Гр. Затем проводят облучение только предстательной железы и прилежащих тканей. Большинство авторов полагают, что рациональная суммарная очаговая доза, рассчитанная в центре железы должна составлять при Т0-1 — 60 Гр, при Т2 — 60-65 Гр, при Т3 — 65-70 Гр, при Т4 — более 70 Гр. При этом доза на расстоянии 4 см от центра железы должна достигать при Т0-2 -6 0 Гр, при Т3 — 65-70 Гр и при Т4 — более 70 Гр (Hanks G. et al., 1985).
При использовании высокоэнергетического излучения ускорителей (> 10 Мэв) облучение первичной опухоли и лимфатических узлов таза рекомендуется проводить с двух противолежащих полей (переднего и заднего), либо с четырех полей (переднего, заднего и двух боковых). Используя фотоны ниже 18 Мэв, передне-задними полями можно подвести дозу до 45 Гр и дополнительную дозу путем подключения боковых полей (Голдобенко Г.В., 1997).
Последние литературные данные свидетельствуют о серьезных достижениях лучевого метода лечения. Так группа RTOG привела отдаленные результаты лучевого лечения крупнейших лечебных учреждений, занимающихся этой проблемой. Они представлены в табл. 35.
Таблица 35. Отдаленные результаты лучевой терапии рака предстательной железы в % (RTOOG, Dearnaley D. ,1998).
Источники: http://medsouz.org/linejnyj-uskoritel, http://xn—-8sbaraautcw0b4e.xn--p1ai/радиология-в-лечении-рака/лечение-рака-медицинский-линейный-ускоритель/, http://medi.ru/info/5976/















































