Метастазы рака предстательной железы в костях и прогрессирование: что будет и как лечить
С доступностью медицинской помощи метастазы рака предстательной железы чаще диагностируются вторично, уже после проведенного лечения. Если мужчина регулярно проходил осмотр у уролога или хирурга, опухоль выявляется на ранних стадиях. Метастазы рака простаты в костях после терапии свидетельствуют о рецидиве опухоли.
Лечение, которое могло предшествовать появлению метастатических очагов:
• хирургическое вмешательство;
• внешняя лучевая терапия (EBRT);
• низкодозная или высокодозная брахитерапия;
• HIFU-абляция;
• криотерапия.
Все вышеперечисленные способы были выполнены, чтобы вылечить/добиться стойкой ремиссии для опухоли простаты.
Но, к сожалению, рецидивирующий рак предстательной железы все еще встречается. Причины – устойчивость к терапии или неправильное определение стадии.
Как узнать, вернулся ли рак

После завершения лечения пациенты наблюдаются у уролога и онколога. Первый признак рецидива опухолевого процесса – непрерывное стабильное увеличение уровня простатспецифического антигена (ПСА) в крови. Этот анализ – способ оценки успешности выполненного лечения. Точное значение ПСА зависит от того, какая именно терапия проводилась.
Для уточнения стадии будут выполнены и другие исследования:
• магнитно-резонансная томография;
• компьютерная томография;
• сцинтиграфия костей скелета.
Какие симптомы и признаки при рецидиве рака простаты с метастазами в кости
Иногда единственным признаком является рост уровня ПСА, а симптомы и признаки рецидива рака появляются позднее.
• астенический синдром (слабость, апатия, быстрая утомляемость);
• потливость;
• боль в костях;
• дизурические расстройства: вялая струя мочи, дискомфорт, капельное мочеиспускание, ноктурия и пр.;
• повышение температуры без видимой причины.
Физические проблемы часто возникают на фоне лечения, но не при прогрессировании процесса. Для уточнения проводят диагностику.
• не все атипичные клетки были уничтожены на первом этапе терапии, со временем они размножились, и стало возможно выявить прогресс с помощью обследования, иногда появляются соответствующие симптомы;
• рак изначально находился на более продвинутой стадии, чем предполагал врач. Единичные клетки могли уже быть вне предстательной железы (в лимфатических узлах или костях), а первичная терапия не была нацелена на устранение этих участков. Достоверно предсказать, как будет вести себя раковая опухоль, не всегда возможно.
Где могут быть опухолевые клетки при прогрессированни патологии
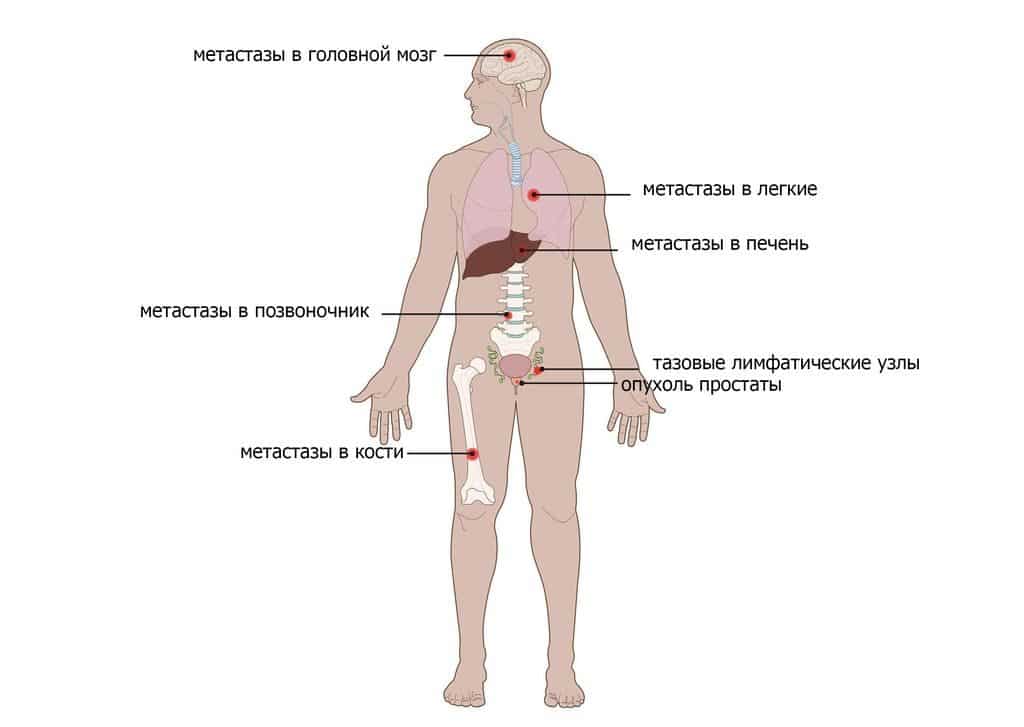
• в простате, если было принято решение не выполнять простатэктомию;
• в ложе простаты после хирургического вмешательства;
• в близлежащих тканях и органах (мочевой пузырь, кишечник, везикулы);
• в отдаленных органах (печень, легкие).
Иногда не представляется возможным выяснить, где находится очаг, который вызывает повышение уровня ПСА. В этом случае может помочь ПЭТ, доступность которой ограничена.
Какие способы существуют для борьбы с распространенным раком простаты
Терапия распространенного рака простаты считается паллиативной, т.е. вылечить патологию уже невозможно. Основная цель – максимальное замедление прогрессирования заболевания, устранение симптомов, улучшение качества и продолжительности жизни.
Все методы имеют преимущества, недостатки и побочные эффекты. Схему терапии подбирают в индивидуальном порядке.
Лечение метастазирующего рака простаты:
Существует два основных вида лечения: направленное на то, чтобы избавиться от рака (лечебные процедуры) и то, которое выполняется, чтобы задержать развитие рака.
Какие процедуры второй линии существуют
В зависимости от распространенности процесса: за пределы капсулы, в другие органы, в костные структуры.
Внешняя лучевая терапия использует лучи для уничтожения раковых клеток. Часто назначается с гормональными препаратами, если подтверждена гормонозависимая опухоль.
Низкодозная /высокодозная брахитерапия – введение в простату крошечных радиоактивных гранул на постоянной/временной основе.
Ультразвук с высокой интенсивностью фокусировки (HIFU)-абляция: ультразвуковые волны используются для нагрева и разрушения атипичных клеток. HIFU выполняют в крупных урологических центрах Росси и за рубежом.
Криотерапия – замораживание и оттаивание предстательной железы для уничтожения раковых клеток. Нет повсеместной доступности способа. Исследовательские работы по изучению эффективности и побочных эффектов криотерапии проводятся до сих пор.
Радикальная простатэктомия, в том числ, роботассистированная – удаление всей предстательной железы, окружающих тканей, тазовых лимфоузлов единым блоком.
Прием препаратов направлен на снижение количества тестостерона либо прекращения его связывания с раковыми клетками в любом участке организма.
Химиотерапия применяется для уничтожения клеток опухоли в любом месте. Может проводиться в комбинации с гормонотерапией. Наиболее высокий процент побочных эффектов.
На основании чего выбирают способ лечения распространенного рака с метастазами:
• ожидаемая продолжительность жизни;
• согласие больного на тот или иной вид лечения;
• сопутствующая патология;
• предыдущий результат от терапии;
• данные клинических исследований.
В зависимости от первичной терапии, какие могут быть варианты:
Лучевая терапия + гормонотерапия
Внешняя лучевая терапия
Хирургия (крайне редко)
Все вопросы, какое лечение лучше при раке предстательной железы, лучше обсудить с врачом.
Что делать, если появились метастазы рака простаты в костях
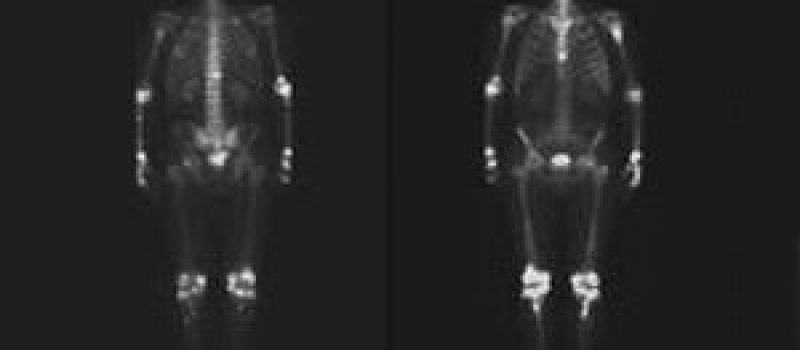
Существуют способы лечения, чтобы улучшить общее состояние и уменьшить боль при раке с метастазами в кости скелета: бисфосфонаты и лучевая терапия.
Лечение лучами при распространенном (метастатическом) раке простаты направлено на замедление прогрессирования и облегчения болевого синдрома в костях.
Гормонотерапия помогает контролировать онкопроцесс в течение многих месяцев или лет.
Раковая опухоль может распространиться куда угодно, но чаще это кости и лимфатические узлы. Боль и повышанная хрупкость костной ткани иногда затрудняет двигательную активность.
У некоторых пациентов присутствует кровь в моче и дискомфорт от набухших лимфатических узлов. Радиотерапия способна помочь в решении этих проблем.
Лучевую терапию также применяют при метастатической компрессии спинного мозга.
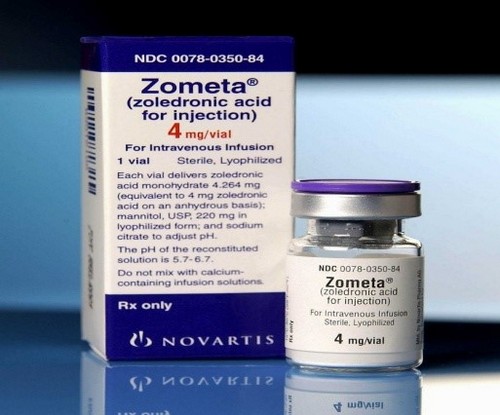
Биофосфонаты – препараты, которые облегчают боль в костях при метастазах рака предстательной железы.
Кости состоят из ткани, которая постоянно меняется. В норме клетки разрушаются и восстанавливаются в процессе жизни. При раковом процессе этот баланс нарушается. Бисфосфонаты помогают предотвратить разрушение костной ткани и стимулировать образование остеокластов в местах деструкции. Это может облегчить боль. Бисфосфонаты также могут быть использованы для лечения гиперкальциемии, при которой отмечают высокий уровень кальция в крови.
В некоторых клиниках бисфосфонаты используются для лечения истончения костей, вызванного гормональной терапией, или для предотвращения и замедления дальнейшего повреждения кости.
Метастазы в костях при раке простаты: недостатки лечения бисфосфонатами
Как и у всех лекарств, есть положительные и отрицательные аспекты от применения бисфосфонатов.
К отрицательным сторонам относят:
необходимость госпитализации для введения лекарства (Зомета, Zometa ®, Золедроновая кислота) каждые 3-4 недели. До появления первых симптомов облегчения требуется определенный промежуток времени, до 3 месяцев.
Риск развития остеонекроза челюсти подразумевает регулярное посещение стоматолога.
Длительность внутривенной инфузии – 15 минут, кратность – 1 раз в 3-4 недели. Перед каждым введением в обязательном порядке прохождение обследования, так как биофосфонаты негативно влияют на функциональную способность почек. Также контролируют кровь на нормальный уровень кальция, магния и фосфата – основных минералов для синтеза новой костной ткани.
Какие побочные эффекты при лечении метастазов в костях от Зометы
Побочные эффекты вариативны от человека к человеку.
Симптомы гриппа
Состояние длится около 24 часов и часто проходит после второго введения препарата. Для облегчения симптомов назначают Парацетомол и лекарства на его основе.
Тошнота и рвота
Диспепсические явления проходят в течение нескольких дней. Если состояние не улучшается, возможно употребление специальных препаратов.
Потеря аппетита

Уменьшение аппетита и даже отвращение к пище – реакция на лечение или токсины от распадающейся опухоли. Через несколько дней самочувствие улучшится, а поможет в этом усиленный питьевой режим и правильное питание при раке предстательной железы.
Болевой синдром
У некоторых мужчин бисфосфонаты провоцируют боль в суставах, мышцах или костях. Если улучшение не наступит через несколько дней, уменьшить боль помогут обезболивающие препараты.
Низкий уровень кальция и фосфата в крови
Бисфосфонаты могут привести к тому, что уровни кальция и фосфата в крови уменьшатся. Для коррекции используют препараты кальция и витамин Д.
Проблемы с почками
Бисфосфонаты нарушают функции почек. Эти явления обратимы, и функциональная способность восстановится после завершения курса лечения.
Конъюнктивит
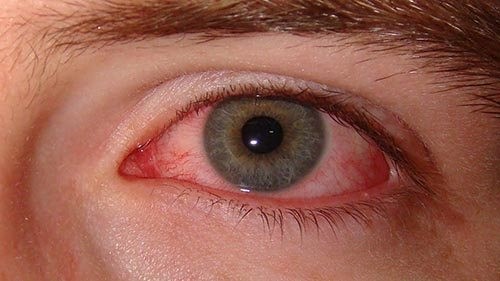
Появляются жалобы на зуд в области глаз, сухость, рези, покраснение. Помогут глазные капли, которые порекомендует окулист, в зависимости от выраженности процесса.
Менее распространенные эффекты:
• сыпь и зуд;
• диарея;
• сердцебиение;
• остеонекроз челюсти.
Боль при метастазах в кости при раке простаты
Современные достижения медицины позволяют бороться с болью при раке и не считать ее нормой. Чем раньше начать лечение боли, тем легче будет ее контролировать.
Различные характеристики боли подразумевают вариативные подходы:
обезболивающие препараты, лучевая терапия, бисфосфонаты, чрескожная стимуляция нерва (TENS), блокада. Значение имеет диетотерапия, посильная физическая активность и эмоциональная поддержка.
Рак предстательной железы — прогнозы выживаемости

Прогноз заболеваемости и смертности
Согласно данным Европейского бюро ВОЗ, в пяти наиболее крупных странах Европы ежегодно регистрируют около 80100 новых случаев заболевания злокачественным новообразованием предстательной железы. К сожалению, в 55-60% случаев эту патологию выявляют на поздних стадиях. В мире ежегодно регистрируется 200250 случаев заболевания предстательной железы. У 70%-80% пациентов патологический процесс имеет тенденцию к прогрессированию.
Рак предстательной железы находится на третьем месте среди онкологических заболеваний мужских половых органов в Западной Европе и на первом в США. Эта довольно распространенная опухоль в большинстве стран занимает второе-третье место по частоте среди злокачественных опухолей у мужчин, а в США — первое место. Ежегодно в РФ регистрируют 1500 новых случаев злокачественных новообразований, в Украине – 25000, а в Европейском Союзе – 86000.
На заболеваемость раком предстательной железы оказывает влияние этническая принадлежность мужчины. Так, установлено, что наиболее подвержены этому заболеванию представители негроидной расы, а самый низкий показатель заболеваемости отмечается в восточноазиатских государствах (Китае, Японии).
Смертность от рака предстательной железы зависит от стадии заболевания, на которой выявляют опухоль, и адекватности проводимого лечения. Известно, что, к сожалению, только 30% пациентам диагноз ставят на первой или второй стадии. Метастазы раковых клеток из предстательной железы находят у 65%-80% мужчин, у которых впервые выявлено заболевание.
Некоторые исследователи указывают, что у 33% мужчин после пятидесяти лет имеется латентная форма рака простаты. Несмотря на латентное течение болезни, первичный диагноз ставится у 1% этих людей. Поскольку у 76% мужчин пожилого возраста имеет место доброкачественная гиперплазия предстательной железы, распознать у них рак становится сложным процессом.
Факторы риска, которые влияют на прогноз заболеваемости раком простаты
Известны некоторые факторы риска, которые повышают вероятность заболеть раком простаты:
A. Возраст. Рак предстательной железы в 75% случаях выявляют после 50 лет.
B. Отягощённая наследственность. При наличии заболевания у ближайших родственников риск возрастает в 2 раза, а если рак диагностирован у 3 близких людей, то степень риска заболеваемости возрастает в 9 раз.
C. Этническое происхождение. У чернокожих афроамериканцев вероятность заболеть раком простаты в 1,5-2 раза выше, чем у белокожих мужчин.
D. Питание. Высокое количество в рационе мужчины животного раза в 3 раза повышает риск заболеваемости. Напротив, употребление продуктов сои предупреждает развитие и прогрессирование РПЖ. Витамин Е уменьшает риск заболеваемости на 1/3, а селен – на2/3. Каротиноиды также уменьшают степень риска возникновения опухоли простаты.
При естественном течении болезни смертность во многом зависит от степени дифференциации опухолевых клеток. Так, при их низкой дифференциации вероятность умереть в течение 10 лет – 10%, а при высокой степени дифференциации раковой ткани этот показатель возрастает до 60%. Если же у пациента выявлено заболевание простаты на поздних стадиях, то они живут от 30 до 35 месяцев. В течение пяти лет умирает 75% пациентов в третьей и четвёртой стадиях рака предстательной железы, а в течение 10 лет – 90%.
Прогноз выживаемости в зависимости от симптомов заболевания
Рак простаты имеет скудные ранние признаки заболевания. Это может быть боль (99%), обструкция мочевыделительных путей (54%) или же гематурия (87%). Однако, эти симптомы характерны и для других заболеваний предстательной железы, поэтому их появление не вызывает онкологической настороженности. В 43% случаях первыми признаками рака простаты становятся боли в костях, которые свидетельствуют о наличии метастазов опухоли.
Выявляемость заболевания улучшили скрининговые программы с применением онкологических маркеров, в частности, ПСА (простатспецифического антигена). До внедрения в программу скрининга определения ПСА локализованные формы рака предстательной железы выявляли в 33% случаях, а после – в 60%-70%.
Характерным признаком неоплазии тканей простаты является анеуплоидия дезоксирибонуклеиновой кислоты в пунктате из предстательной железы. Она содержится в 50% раков простаты. Её определение позволяет выявить злокачественное новообразование почти у 50% пациентов.
Программа скрининга рака простаты включает такие методы обследования пациентов:
пальцевое ректальное исследование позволяет в 87% пациентов выявить гиперплазию простаты, наличие узлов, оценить их плотность и характер поверхности, в 37% пациентов выявить рак предстательной железы;
чувствительность теста ПСА достигает 95%;
метод ТРУЗИ информативен в 605 случаях;
комбинация ПСА+ метод ТРУЗИ эффективна в 80% случаях, а ПСА+ПРИ – в 83% пациентов;
пункционная биопсия новообразования подтверждает диагноз у 15% пациентов с изолированным повышением уровня ПСА и у 80% мужчин, которым проводилось пальцевое исследование прямой кишки+определение уровня ПСА;
ультразвуковое исследование предстательной железы при помощи ректального датчика выявляет рак 1 95% пациентов, которые находятся в группе риска;
трансуретральная биопсия предстательной железы информативна в 81% пациентов;
аспирационная биопсия выполняется из узлов небольшого размера, которые определяются пальпаторно во время пальцевого исследования;
КТ и МРТ обладают 100% чувствительностью при определении метастазов опухоли.
Выживаемость при разных методах лечения
Одним из методов хирургического лечения рака предстательной железы является радикальная простатэктомия. В последнее время в 93% случаев она выполняется с помощью лапароскопа. Смертность после операции колеблется в диапазоне от 0% до 1,2%. В первые 6-7 недель после оперативного вмешательства у 8% пациентов развивается стриктура. У 6% прооперированных отмечается стрессовое недержание мочи АО время физической нагрузки, которое требует использование прокладок. Применение во время операции нервосберегающих технологий привело к тому, что потенция сохраняется у 60%-80% мужчин, которые перенесли операцию.
У ряда пациентов выявляют рак предстательной железы 2 степени. Прогноз таков: пятилетняя выживаемость пациентов после этого оперативного вмешательства составила 99%, десятилетняя – 90%, а пятнадцатилетняя – 82%. Если же операция выполнялась пациентам, которым поставлен диагноз «рак предстательной железы 3 степени», прогноз становится несколько иным. Показатель десятилетней выживаемости не превышает 79%.
Пациентам на третьей стадии рака простаты после операции показана адъювантная терапия химиотерапевтическими препаратами. Она на 70% уменьшает риск местного рецидива опухоли и улучшает показатели выживаемости.
Адъювантная терапия гормональными препаратами показана пациентам с метастазами в лимфоузлы. При проведении в послеоперационном периоде адъювантной монотерапии антиандрогенами в комбинации с лучевой терапией на 65% повышает выживаемость в течение 3 летнего наблюдения.
Показаниями для назначения лучевой терапии является рак предстательной железы 1 и 2 степени, прогноз у которых оптимистичный, но они не желают оперироваться или имеют противопоказания к оперативному вмешательству. Он показан и при раке простаты третьей степени. После лучевого лечения у 98% пациентов наблюдаются не выраженные реакции со стороны толстого кишечника и мочевыводящих путей. У 55%-60% пациентов наблюдается снижение или отсутствие потенции. В 6% пациентов возникает диарея, в 13% прямокишечное кровотечение, у 10% — гематурия, а в 14%-стриктура уретры.
Брахитерапия является альтернативным методом лучевого лечения. При применении этого метода у 99% пациентов отсутствует повреждение здоровых тканей. При раке предстательной железы 1 и 2 степени прогноз при проведении брахитерапии хороший. Выздоровление наступает в 95% случаев.
У пациентов, которым диагностирован рак 3 степени, прогноз хуже; им брахитерапию следует сочетать с наружным облучением. У мужчин, которым определён рак предстательной железы 4 степени, прогноз значительно хуже. Им показано комплексное лечение, включающее симптоматическую терапию.
Пациентам с диагнозом « рак предстательной железы 4 степени, прогноз которых со временем ухудшается, может понадобиться купирование болей. Нарастающие боли лечат по трёхуровневой программе:
a. 1 уровень – при наличии не выраженного болевого синдрома назначают ненаркотические анальгетики, которые блокируют синтез медиаторов боли;
b. 2 уровень – при умеренной боли показано назначение неопиоидных препаратов и слабых опиоидов;
c. 3 уровень используют при нарастании боли и неэффективности анальгезии; назначают комбинацию неопиоидных анальгетиков с сильными опиоидами.
Лучевая терапия, которая проводится у некурабельных пациентов, уменьшает интенсивность боли у 36%-70% пациентов и приводит к её полному исчезновению в 36%-65% случаев. Эффективность термолучевой терапии в лечении больных раком предстательной железы составляет 79%, а стандартного облучения – 48%. Пациента, страдающим раком предстательной железы 4 степени, прогноз которых можно улучшить, назначают комбинированное лучевое лечение и эстрогенотерапию. Её эффективность составляет 96%.
Некоторые онкологи указывают на особую эффективность лечения рака простаты комбинацией лучевой терапии с эстрогенотерапией. Положительного эффекта достигают в 96% случаев, а при сочетании лучевой, полихимиотерапии и эстрогенотерапии эффективность составила 93%. У 87% пациентов был достигнут полный регресс опухоли. У них в течение 3 лет не наблюдалось рецидивов.
Рецидив опухоли при раке предстательной железы возникает преимущественно на протяжении первого года после оперативного вмешательства. Он возрастает по мере увеличения стадии патологического процесса. Например, при первой стадии рака простаты рецидивы не возникают в 90%-100% пациентов, а при лечении рака второй стадии эти цифры значительно хуже (69%-79%).
Важным критерием радикальности выполненной простатэктомии является низкий уровень ПСА в послеоперационном периоде. О рецидиве заболевания можно судить в том случае, когда уровень ПСА будет резко возрастать. Об этом можно с уверенностью говорить только тогда, когда в двух последних анализах концентрация ПСА будет превышена в 2 раза по сравнению с первоначальным исследованием. У 25% пациентом с запущенными стадиями рака предстательной железы выполняют паллиативные оперативные вмешательства, к которым относится эпицистэктомия.
Невзирая на кажущейся радужности перспективы при наличии рака предстательной железы, даже его локальная форма представляет угрозу жизни человека и в перспективе может привести к летальному исходу. При исследовании сыворотки крови на уровень ПСА диагноз можно поставить на 6-7 лет раньше, а это существенно улучшает прогноз выживаемости. При своевременной диагностике заболевания выполняется радикальная простатэктомия, после которой процент выживаемости в течение 15 лет очень высокий. Эндоскопическая операция значительно уменьшает период послеоперационной реабилитации.
Рецидив рака простаты после радикального лечения
Риск рецидива рака простаты (местного или системного) в течение 10 лет после простатэктомии или лучевой терапии составляет 27-53%. В течение 5 лет после первоначального лечения от 16 до 35% больных получают противорецидивное лечение.
Ранее под рецидивом понимали опухоль, пальпируемую через прямую кишку, а также отдалённые метастазы. Сейчас рецидивом считают рост уровня ПСА. Критерием рецидива после простатэктомии обычно считают уровень ПСА 0,2 нг/мл и более при двух последовательных измерениях. О рецидиве после лучевой терапии, согласно критериям ASTRO, можно говорить при трёх последовательных повышениях уровня ПСА.
Код по МКБ-10
Местный и системный рецидив рака простаты
Если обнаружено повышение уровня ПСА, важно установить характер рецидива — местный или системный. После простатэктомии может идти речь о местном рецидиве, в остальных случаях — только о системном рецидиве или их сочетании.
Отличить местный рецидив от системного помогает время до повышения уровня ПСА, скорость прироста и время удвоения содержания ПСА, исходный уровень его и индекс Глисона.
Увеличение уровня ПСА в первые пол года после операции обычно указывает на системный рецидив. Медиана времени удвоения уровня ПСА при системных рецидивах может составлять 4,3, при местных — 11,7 мес. Скорость прироста уровня ПСА менее 0,75 нг/мл в год наблюдают у больных с местными рецидивами, более 0,7 нг/мл в год — у больных с отдалёнными метастазами.
На местный рецидив после лучевой терапии указывает медленный отсроченный рост уровня ПСА. Подтверждением местного рецидива служит положительный результат биопсии, выполненной через 18 мес. после облучения и позже (при отсутствии отдалённых метастазов по данным КТ, МРТ и сцинтиграфии).
Вероятность местного рецидива после простатэктомии составляет 80% при позднем подъёме уровня ПСА (более 3 лет), времени удвоения уровня ПСА более 11 мес, индексе Глисона менее 6 и стадии процесса ниже рТ3аN0 и pTxR1 Вероятность системного рецидива после простатэктомии превышает 80% при раннем подъёме уровня ПСА (менее одного года), времени удвоения уровня ПСА 4-6 мес, индексе Глисона 8-10, стадии рТ3b и pTxN1. Местный рецидив после лучевой терапии и HIFU диагностируют при положительном результате биопсии при отсутствии отдалённых метастазов. Биопсия предстательной железы показана лишь отдельным больным при планировании повторного местного лечения (например, простатэктомии или повторного сеанса HIFU).
Обследование при подозрении на рецидив рака простаты
Для подтверждения рецидива при повышении уровня ПСА обычно проводят физикальное обследование, УЗИ, КТ или МРТ малого таза, биопсию ложа опухоли и области анастомоза. При отсутствии симптомов эти исследования редко обнаруживают опухоль, так как рост уровня ПСА обычно происходит за 6-48 мес до явного рецидива.
Пальцевое ректальное исследование при нулевом или очень низком уровне ПСА обычно не приносит результатов. При повышении уровня ПСА назначают МРТ малого таза, КТ брюшной полости и сцинтиграфию костей, но из-за низкой чувствительности и специфичности при раннем рецидиве эти исследования малоинформативны. При подъёме уровня ПСА после простатэктомии результат сцинтиграфии положителен лишь у 4,1% больных. Вероятность положительного результата сцинтиграфии не превышает 5%, пока уровень ПСА не достигнет 40 нг/мл. Средний уровень ПСА, при котором сцинтиграфии обнаруживает метастазы должен превышать 60 нг/мл, а скорость прироста уровня ПСА — 22 нг/мл в год. Уровень и скорость прироста содержания ПСА позволяют предсказать результат сцинтиграфии, а скорость прироста уровня ПСА — результат КТ. Таким образом, при уровне ПСА менее 20 нг/мл или скорости прироста содержания ПСА менее 20 нг/мл в год сцинтиграфия и КТ не приносят дополнительной информации. Эндоректальная МРТ обнаруживает местный рецидив у 81% больных со средним уровнем ПСА 2 нг/мл.
ПЭТ рекомендуют для ранней диагностики рецидивов различных опухолей.
Сцинтиграфия с антителами к простатическому мембранному антигену (простасцинт) — один из новых методов обнаружения рецидивов. Его диагностическая точность достигает 81%. Независимо от уровня ПСА метод обнаруживает возникновение рецидива у 60-80% больных, что может помочь при выборе тактики лечения. Сцинтиграфия с этими антителами положительна у 72 из 255 больных с уровнем ПСА 0,1-4 нг/мл после простатэктомии, причём накопление изотопа наблюдают при любом уровне ПСА.
Биопсия зоны анастомоза позволяет обнаружить рецидив только у 54% больных. Лишь при наличии пальпируемого или гипоэхогенного образования вероятность положительного результата приближена к 80%. Существует четкая зависимость между этим показателем и уровнем ПСА: при содержании ПСА менее 0,5 нг/мл результат положителен у 28% больных, при уровне ПСА более 2 нг/мл — у 70% больных Учитывая эти данные, биопсию из зоны анастомоза обычно не берут и ориентируются на уровень ПСА и скорость его удвоения. Кроме того, выживаемость при доказанных рецидивах примерно такая же, как при регистрации изолированного повышении ПСА.
Согласно рекомендациям ASTRO, при повышении уровня ПСА после лучевой терапии биопсия предстательной железы не показана. Впрочем биопсия имеет ключевое значение для решения вопроса о простатэктомии или HIFU у таких больных. После лучевой терапии (дистанционной или брахитерапии) биопсию обычно проводят не ранее чем через 18 мес после криодеструкции или через 6 мес после ультразвуковой деструкции.
Что нужно обследовать?
К кому обратиться?
Лечение рецидива рака простаты
Лечение рецидива рака простаты после радикальной простатэктомии
Сроки и тактика лечения при подъёме уровня ПСА после простатэктомии или лучевой терапии вызывают дискуссии. В случае рецидива после операции возможны наблюдение, облучение ложа опухоли, HIFU-терапия рецидива, гормонотерапия рака простаты (в том числе комбинированная, периодическая или сочетанное применение финастерида и антиандрогенов), а также сочетание гормоно- и химиотерапии. Эти методы применимы и при рецидиве после лучевой терапии.
Гормонотерапия
При высоком дооперационном уровне ПСА (более 20 нг/м, индексе Глисона более 7, нерадикальной операции и местнораспространённых опухолях рТ3b, рТxN1) целесообразна ранняя гормонотерапия. Однако ее влияние на выживаемость до сих пор не установлено. При ранней гормонотерапии метастазы возникают реже, чем при отсроченной, выживаемость в обоих случаях примерно одинаковая. Необходимость гормонотерапии подтверждает испытание МRС, в котором рецидив был отмечен у всех больных, получивших лучевую терапию по поводу роста уровня ПСА после простатэктомии при опухолях рТ3b, рТхN1, и индексе Глисона 8.
Монотерапию антиандрогенными препаратами больные переносят лучше, чем комбинированную (реже возникают приливы, снижение потенции, утрата полового влечения), однако антиандрогены вызывают гинекомастию и боль в сосках. У больных без отдалённых метастазов бикалутамид (по 150 мг/сут) достоверно снижает риск прогрессирования заболевания. Таким образом, антиандрогены могут быть альтернативой кастрации при повышении уровня ПСА после радикального лечения (особенно у относительно молодых больных без сопутствующих заболеваний).
Наблюдение при рецидиве рака простаты
Динамическое наблюдение обычно проводят при индексе Глисона менее 7, позднем (через 2 года после операции) повышении уровня ПСА и времени его удвоения более 10 месяцев. В таких случаях медиана времени до возникновения метастазов составляет 8 лет, а медиана времени от возникновения метастазов до наступления летального исхода — ещё 5 лет.
HIFU-терапия
В последнее время появляется всё больше данных о результатах HIFU-терапии местного рецидива после РПЭ. Чаще всего рецидив обнаруживают при ТРУЗИ и подтверждают гистологически (биопсия). Тем не менее HIFU-терапия лить отодвигает сроки назначения гормонотерапии. Точные данные о выживаемости отсутствуют.
Клинические рекомендации по лечению рецидива после простатэктомии
При местном рецидиве и уровне ПСА менее 1,5 нг/мл показана лучевая терапия до СОД 64-66 Гр,
Если больной ослаблен или возражает против облучения, при местном рецидиве возможно динамическое наблюдение
При росте уровня ПСА, указывающем на системный рецидив, показана гормонотерапия, так как она снижает риск метастазирования.
В качестве гормонотерапии можно использовать аналоги гонадолиберина, кастрацию или бикалутамид (по 150 мг/сут).
Лечение рецидива после лучевой терапии
Наиболее часто больные с рецидивом после лучевой терапии получают гормонотерапию (до 92%). Без лечения время от повышения уровня ПСА до манифестации рецидива составляет около 3 лет. Кроме гормонотерапии при рецидиве после облучения возможно и местное лечение — простатэктомия, HIFU-терапия, криотерапия, брахитерапия. Простатэктомия не нашла широкого применения из-за частых осложнений (недержание мочи, повреждение прямой кишки), а также из-за высокого риска местного рецидива. Однако при тщательном отборе больных эта операция может обеспечить длительный безрецидивный период,
По последним данным. 5-летняя безрецидивная выживаемость после лучевой терапии соответствует таковой после первичной простатэктомии, проведённой на тех же стадиях заболевания, 10-летняя выживаемость составляет 60-66%. В течение 10 лет от прогрессирования опухоли умирают 25-30% больных. При локализованных опухолях, отсутствии опухолевых клеток в крае резекции, инвазии семенных пузырьков и метастазирования в лимфатические узлы безрецидивная выживаемость достигает 70-80% по сравнению с 40-60% при местнораспространённых опухолях.
Простатэктомия при местном рецидиве оправдана при отсутствии тяжелых сопутствующих заболеваний, ожидаемой продолжительности ЖИЗНИ не менее 10 лет, опухолях индексе Глисона менее 7 и уровне ПСА менее 10 нг/мл. В остальных случаях до операции сложно определить распространённость опухоли, что повышает риск передней или тотальной экзентерации, осложнений, а также повторною рецидива.
Рекомендовано динамическое наблюдение за больными с вероятным местным рецидивом (из группы низкого риска, с поздним рецидивом и медленным ростом уровня ПСА), настроенными против повторного радикального лечения. Ретроспективный анализ не обнаружил преимуществ гормонотерапии по сравнению с динамическим наблюдением при времени удвоения уровня ПСА более 12 мес; 5-летняя выживаемость без метастазирования составила 88% при гормонотерапии и 92% — на фоне наблюдения.
Клинические рекомендации по обследованию при подозрении на рецидив рака простаты
После простатэктомии, если уровень ПСА менее 20 нг/мл и скорость его прироста менее 20 нг/мл в год, КТ брюшной полости и малого таза малоинформативна.
Эндоректальная МРТ помогает обнаружить местный рецидив при низком уровне ПСА (1-2 нг/мл). ПЭТ пока не получила широкого распространения.
Сцинтиграфия с мечеными антителами к простатическому мембранному антигену позволяет обнаружить рецилив у 60-80% больных независимо от уровня ПСА.
Биопсию для подтверждения местного рецидива проводят через 18 мес и более после облучения.
Клинические рекомендации по лечению рецидива после лучевой терапии
У отдельных больных с местным рецидивом возможно выполнение простатэктомии.
При противопоказаниях к операции возможно проведение брахитерапии, HIFU-терапии или криодеструкции.
При вероятном системном рецидиве возможна гормонотерапия рака простаты.
Клинические рекомендации по лечению рецидивов после радикального лечения
Вероятный местный рецидив после простатэктомии
Возможна лучевая терапия в дозе не менее 64 Гр желательно начать её при уровне ПСА менее 1.5 нг/мл.
В остальных случаях предпочтительно наблюдение с последующей гормонотерапией
Вероятный местный рецидив после лучевой терапии
В отдельных случаях возможна простатэктомия, но больному нужно сообщить о сравнительно высоком риске осложнений.
В остальных случаях предпочтительно наблюдение с последующей гормонотерапией.
Вероятный системный рецидив
Ранняя гормонотерапия замедляет прогрессирование и может увеличить выживаемость по сравнению с отсроченной. Местное лечение проводят только в паллиативных целях.
Источники: http://genitalhealth.ru/390/Metastazy-raka-predstatelnoy-zhelezy-v-kostyakh-i-progressirovanie-chto-budet-i-kak-lechit/, http://www.oncoforum.ru/o-rake/prognozy-vyzhivaemosti/rak-predstatelnoy-zhelezy-prognozy-vyzhivaemosti.html, http://m.ilive.com.ua/health/recidiv-raka-prostaty-posle-radikalnogo-lecheniya_109198i15957.html










































