Очаг атипической гиперплазии предстательной железы
Атипичная аденоматозная гиперплазия (син.: ААГ, аденоз, атипичный аденоз, мелкоаципарная атипичная гиперплазия простаты) характеризуется узловой пролиферацией мелких и/или средних по размеру ацинусов, не имеющих структурных и цитологических признаков малигнизации. Как и при ПИН, нет ни какой-либо характерной клинической симптоматики, ни очерченной макроскопической картины. В пунктатах и материале, полученном после трансуретральной резекции простаты, ААГ обнаруживается у 1,5—19,6 % пациентов, а после радикальной простатэктомии — в 28,9—33,0 % случаев. У подавляющего большинства больных ААГ поражает транзиторную зону простаты, в то время как периферическая зона органа страдает не чаще, чем в 2 % случаев. Изредка, при наличии ДГП, развивается многоочаговый процесс с вовлечением в него обеих зон.
Малигнизация при атипичной аденоматозной гиперплазии наблюдается не чаще, чем при ДГП. Кроме внешнего поверхностного морфологического сходства очагов ААГ с некоторыми вариантами высокодифференцированной карциномы ни возраст пациентов (на 5—10 лет моложе больных раком), ни склонность к периуретральной локализации указанных очагов не свидетельствуют о связи с раком. Вместе с тем утрата аллелей 8р22, появление микросателлитных маркеров в позициях 7q, 8p, 8q и 18q, обнаруженные у 8—40 % больных с ААГ, наводят на мысль о возможности такой связи. Прерывистый характер окрашивания на цитокератин 34BЕ12 базального слоя выстилки ацинусов в очагах ААГ, а также возросшие, по сравнению с нормой, среднее значение диаметра ядер эпителиоцитов и уровень их пролиферации свидетельствуют о некоем промежуточном положении эпителиоцитов при ААГ между их нормальными и раковыми аналогами.
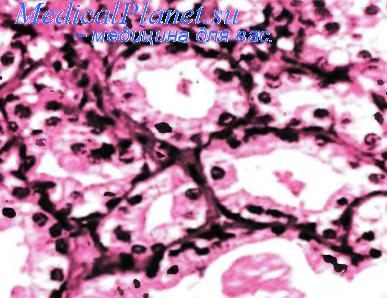 Атипичная аденоматозная гиперплазия простаты
Атипичная аденоматозная гиперплазия простаты
Под микроскопом очаги атипичной аденоматозной гиперплазии обычно четко очерчены и имеют диаметр 1—3 мм, редко достигая I см. При небольшом увеличении микроскопа видно, что они состоят в основном из тесно лежащих («спинка к спинке») мелких и средних ацинусов, часто создающих дольковый характер роста внутри и/или поблизости от узла ДГП. Иногда обнаруживается явная перинодулярная локализация. Ацинусы могут варьировать по форме, но бывают и мономорфными. Между ними у некоторых больных встречается сильно развитая строма и по краям очага ААГ — ограниченная инфильтрация эпителиоцитов, не имеющая характера инвазивного роста. Выстилка ацинусов представлена довольно светлыми кубическими и/или цилиндрическими эпитслиоцитами секреторно-люминального типа, формирующими неровные, часто причудливые, реже округлые очертания просвета. Просвет ацинусов чаще всего пуст, но местами содержит амилоидные тельца, изредка кристаллоиды и базофильные муцины.
Эпителиоциты обладают умеренно развитой цитоплазмой, иногда слабо эозинофильной и слегка зернистой, а также округлыми полиморфными ядрами с равномерно распределенным хроматином и базофильными ядрышками, обычно менее 1 мкм в диаметре (как и в норме). Эти клетки позитивны к ПСА, кислой фосфатазе и Leu-7. Окраска на высокомолекулярный цитокератин 34ВЕ12 выявляет рассеянные элементы базального типа. Строма очагов ААГ, как правило, не содержит воспалительного инфильтрата и может быть склерозирована в разной степени. ААГ следует дифференцировать от мелкоацинарной аденокарциномы.
Патологическая анатомия рака предстательной железы
Рак предстательной железы развивается в железистых элементах паренхимы и прилежащих к ней терминальных канальцах периферической зоны железы. В процессе старения организма в периферической зоне нарастает количество очагов атипичной гиперплазии, отличающейся от железистой гиперплазии, связанной с развитием аденомы предстательной железы, дезорганизацией железистых структур. Атипичная гиперплазия развивается в зонах с сохранившейся секреторной активностью эпи гелия, подвергающихся в последующем диффузной железистой гиперплазии, что отражает биологическую взаимосвязь между этими процессами и возникновением гистологической картины рака. Эволюция рака предстательной железы включает продолжительное предраковое состояние, при котором повышенная чувствительность нормального эпителия к андрогенной стимуляции и последующая утрата гормональной зависимости являются ключевыми факторами в стимуляции злокачественного роста. Возникающая при этом атипичность клеток отражает потерю их андрогенозависимости.
В начальной стадии развития рака предстательной железы определяется микроскопический очаг малигнизации, включающий область значительного или слабовыраженного атипичного разрастания эпителия. Большинство таких очагов локализуются в периферической части железы и имеют размеры 0,2 —2,1 мм. Гистологически они относятся к светлоклеточному канальцево-альвеолярному или темноклеточному канальцевому раку. При развитии злокачественного процесса многочисленные микроскопические инфильтраты распространяются среди нормальной железистой ткани. При этом участок малигнизации часто оказывается мультицентрическим с разрастанием соединительной ткани. Постепенно происходит конденсация патологического фокуса в раковый узел, пальпируемый при ректальном исследовании. При гистологическом исследовании обнаруживаются области атипичных микроацинусов, занимающих несколько участков в задненижних отделах железы, внутри капсулы. В последующем размеры узла увеличиваются и он занимает значительную часть железы, но не распространяется за ее пределы. Это сопровождается значительной деформацией поверхности долей или доли железы при отсутствии вовлечения в процесс латеральных бороздок и семенных пузырьков. В дальнейшем происходит диффузная инфильтрация ткани железы с распространением злокачественного процесса на ее капсулу, семенные пузырьки и окружающую железу богатую сеть лимфатических и венозных сплетений. Инвазия прямой кишки и перипростатической клетчатки является результатом пенетрации капсулы железы. В дальнейшем в процесс вовлекаются шейка мочевого пузыря, предстательная и мембранозная части мочеиспускательного канала.
Большая часть рака предстательной железы с явными клиническими проявлениями заболевания относится к аденокарциномам, составляющим около 90% всех гистологических форм злокачественных новообразований предстательной железы. Основными признаками аденокарциномы являются нарушения дифференциации желез и анаплазия ядер. Общая патологическая характеристика рака предстательной железы включает расположение простатических ацинусов бок о бок, отсутствие базальных клеток в однослойном эпителии, выстилающем ацинусы, клетки располагаются в виде гроздьев, клеточные границы неотчетливы, в клетках обнаруживаются большие эозинофильные ядрышки, железки приобретают вид линейных инфильтратов в фиброзно-мышечной строме, выраженность ядерного гиперхроматизма, периневральная инфильтрация. Аденокарциномы предстательной железы классифицируются на дифференцированные (образующие при своем росте железистые структуры) и недифференцированные (с отсутствием желез). По степени дифференциации различают высоко-, умеренно- и низкодифференцированные формы рака предстательной железы. По характеру строения желез аденокарциномы дифференцированного типа разделяются на крибриформные, папиллярные и смешанного крибриформно-папиллярного строения.
Важным показателем доброкачественных и злокачественных изменений в простатических железках может служить выстилающий их эпителий, однослойный в случае злокачественной биотрансформации ацинусов с отсутствием базального слоя, и двухслойный в железках аденомы предстательной железы. В высокодифференцированных аденокарциномах отмечается морфологическая однородность эпителия, железистые структуры представлены маленькими прилежащими друг к другу ацинусами. Эпителиальные клетки цилиндрической формы с бледной, субгранулированной цитоплазмой, в нижней трети которой располагаются гиперхроматичные ядра.
Умеренно дифференцированная аденокарцинома характеризуется меньшей выраженностью регулярности желез, отдельные ацинусы слабо демаркированы, в них прослеживается вариабельность просветов. Железы выстланы низким цилиндрическим или кубическим эпителием с недостаточно четкими клеточными границами, гиперхроматичными ядрами и редкими митозами.
Низкодифференцированная аденокарцинома состоит из маленьких, нерегулярных, плотно сжатых ацинусов со слабо определяемыми просветами, выстланными кубическим или многослойным эпителием со скудной цитоплазмой и темными маленькими ядрами. В недифференцированном раке предстательной железы наблюдается полная утрата железистых структур, эпителиальные клетки расположены кучкообразно и в виде тяжей или струн, массивно инфильтрирующих строму, выражены митозы. При развитии рака предстательной железы проявляется выраженная анаплазия ядер. Ядра эпителиальных клеток характеризуются полиморфизмом, изменяются в размере и форме.
Гистологическая картина латентной карциномы характеризуется одиночными очагами пролиферации железистого эпителия. Развитие злокачественного процесса ограничено небольшим участком ткани с отсутствием тенденции к эксцентрическому росту. В противоположность клинически явной карциноме латентная форма редко включает многочисленные зоны крибриформно-папиллярных структур или недифференцированных желез, выявление которых не дает оснований расценивать рак простаты как скрытопротекающее заболевание. Очаги латентного рака предстательной железы обнаруживаются случайно на аутопсии или в ткани удаленных аденоматозных узлов. Для повышения вероятности выявления микроочагов рака предстательной железы в ткани удаленной аденомы целесообразно делать срезы, ориентированные к заднему краю энуклеации аденоматозных узлов, прилежащему к истинной предстательной железе — месту развития рака. При этом число срезов, произведенных у заднего края энуклеации аденомы по отношению к ткани, расположенной кпереди от мочеиспускательного канала, должно находиться в соотношении 3:1. Этот метод позволяет повысить частоту выявления латентной карциномы в ткани удаленных аденоматозных узлов с 6—10% до 20 — 28%. Гистологическая картина оккультного рака предстательной железы в большинстве случаев включает крибриформно-папиллярные структуры. При оккультной форме метастазы проявляются до выявления первичного очага опухоли.
Итак, аденома и рак имеют различную локализацию в железе и определенный, присущий каждому из этих заболеваний, патологоанатомический субстрат. Аденома предстательной железы первоначально развивается в пери- и парауретральной области в виде сферических масс, включающих фиброзно-мышечные и эпителиальные компоненты, которые при дальнейшем своем росте приобретают размеры и конфигурацию, зависящую от сопротивления окружающей ткани истинной предстательной железы и шейки мочевого пузыря. В отличие от эпителия, выстилающего нормальные простатические железки, эпителий аденомы предстательной железы характеризуется значительной вариабельностью от высокого цилиндрического до уплощенного кубического. Аденоматозные железки, различные по своим размерам, нередко образуют большие кистозные железы с более выраженной складчатостью выстилающего их эпителия и многочисленными выступающими в просвет железок «зубцами». В то же время не существует различий между аденомой предстательной железы и нормальной железой на клеточном уровне эпителия. Рак предстательной железы развивается из железистых элементов наружного отдела железы. Основным отличием рака предстательной железы от аденомы предстательной железы являются нарушение нормальной железистой структуры с беспорядочным расположением железок, отсутствие наружного базального слоя, выстилающего железки, нарушение целости основной мембраны ацинусов, анаплазия ядер. В ткани рака простаты в противоположность аденоме предстательной железы выражены патологические изменения на клеточном уровне — изменение полярности органелл, патологические включения, ядерный полиморфизм, дефект основной мембраны железок.





















Главное меню
Главное меню
Морфологические изменения в ткани предстательной железы при доброкачественной гиперплазии
Обсуждая морфологические изменения в ткани предстательной железы при доброкачественной гиперплазии (ДГПЖ) прежде всего необходимо остановиться на вопросах терминологии, поскольку изобилие синонимов этого заболевания создает существенные трудности в понимании сути патологического процесса.
Практикующим урологам очевидно, что ухудшение мочеиспускания при ДГПЖ (инфравезикальная обструкция, снижение объемной скорости мочеиспускания, увеличение количества остаточной мочи) обусловлено увеличением объема предстательной железы. Увеличение объема органа, ткани, клетки, внутриклеточных органелл в общей патологии обозначается термином гипертрофия. Этот процесс реализуется увеличением количества составляющих компонентов, называемым гиперплазия. Другими словами, увеличение объема органа происходит либо за счет увеличения объема составляющих его клеточных элементов (гипертрофия клеточных элементов), либо за счет увеличения их количества (гиперплазия клеточных элементов). В свою очередь клеточные элементы могут увеличиваться в объеме за счет увеличения количества или объема внутриклеточных органелл [1].
По сути, в основе любого вида гипертрофии лежит процесс гиперплазии, разница состоит только в том, что берется за начальную точку отсчета. Исключение составляют случаи, когда увеличение объема органа происходит за счет опухолевого роста, доброкачественного или злокачественного. Эти случаи в понятие гипертрофии не входят. Следовательно, термин гипертрофия предстательной железы имеет равные права с термином гиперплазия предстательной железы, однако последний термин предпочтительнее, поскольку лучше раскрывает суть патологического процесса в предстательной железе.
В настоящее время подавляющее большинство урологов и даже патологоанатомов необоснованно применяют термин аденома предстательной железы, относя, таким образом, данное заболевание к группе опухолевых процессов (поскольку аденома это доброкачественная опухоль, развивающаяся из железистого эпителия) [2]. В то же время известно, что в подавляющем большинстве случаев как доброкачественная, так и злокачественная опухоли развиваются моноцентрически. Полицентрический рост опухоли встречается крайне редко. При ДГПЖ уролог, осуществляющий оперативное вмешательство, практически всегда обнаруживает в предстательной железе множество узлов различной величины. Это свидетельствует о полицентрическом развитии патологического процесса при этом заболевании. Естественно, возникает вопрос: что лежит в основе формирования этих узлов, что они собой представляют?
Результаты исследований, проводимые на протяжении многих лет в НИИ урологии, позволили определить основные этапы морфогенеза гиперпластических узлов, развивающихся в ткани предстательной железы при ДГПЖ.
Хорошо известно, что предстательная железа состоит из паренхимы, представленной железистой тканью, и стромы, имеющей фибромускулярное строение. Характерно, что клеточные элементы стромы имеют морфологические признаки как фибробласта клетки собственно соединительной ткани, так и лейомиоцита гладкомышечной клетки [3]. Узловатые структуры, приводящие к увеличению объема органа, в большинстве случаев имеют железистое строение и проходят в своем развитии ряд последовательно сменяющих друг друга стадий. Переход одной стадии в другую сопровождается появлением нового качественного признака.
Начинается процесс с образования структуры, состоящей из 2-3 плотно прилежащих друг к другу железок формируется пролиферативный центр I стадии развития (рисунок 1). В прилежащих отделах органа железа сохраняет свое обычное строение. Стромальные элементы, окружающие вновь образованную структуру, уплотняются, а окрашивание пикрофуксином по Ван Гизону показывает, что миофибриллярная строма трансформируется в грубоволокнистую соединительную ткань, утрачивая признаки гладкомышечных клеток.
Дальнейшее развитие процесса приводит к значительному увеличению количеств ацинарных структур (гиперплазия). Таким образом формируются микроскопические узелки, в которых происходит усиленная пролиферация железистой ткани. Это является свидетельством формирования II стадии развития пролиферативного центра (рисунок 2). Стромальные элементы уплотняются в еще большей степени, и поэтому создается ложная картина формирования вокруг пролиферативного центра соединительнотканной капсулы. Проведение серийных срезов, однако, показывает, что эти пролиферативные центры имеют хорошо выраженное радиальное строение по типу пролиферативных центров Сэмба в молочной железе, а соединительнотканные волокна, окружающие пролиферативный центр, интимно связаны с соединительнотканным каркасом внутри него.
Прогрессирование патологического процесса сопровождается формированием в периферических отделах пролиферативных центров дополнительных очагов пролиферации, т.е. своеобразных дочерних пролиферативных центров. Этот качественный признак появление дочерних фокусов пролиферации является морфологическим проявлением формирования III стадии развития пролиферативного центра (рисунок 3).
Постоянное прогрессирование пролиферативной активности ацинарных структур в значительной степени затрудняет отток секрета из ацинусов предстательной железы, формирующих пролиферативный центр, что приводит к их кистозному расширению. Именно этот качественный S признак свидетельствует о том, что патологический процесс перешел в следующую, IV стадию развития пролиферативных центров (рисунок 4).
В дальнейшем ситуация еще более усугубляется: весь пролиферативный центр, или большая его часть, состоит из таких кистозно расширенных ацинусов. Выстилающие их железистые клетки распластываются по базальной мембране, уплощаются и атрофируются. Кистозное расширение ацинарных структур с атрофией выстилающего их эпителия манифестируют терминальную, V стадию развития пролиферативных центров при ДГПЖ (рисунки 5, 6).
Внутриацинарное нарушение оттока секрета в связи с пролиферативным процессом уже на ранних стадиях его развития может привести к формированию конкрементов внутри ацинусов.
Таким образом, последовательность морфогенетических стадий развития пролиферативных центров выглядит следующим образом:
- I стадия образование фокуса, состоящего из 2-3 плотно прилежащих друг к другу ацинарных структур;
- II стадия резкое увеличение количества железистых структур, формирующих пролиферативный центр;
- III стадия появление в периферических отделах пролиферативного центра «дочерних» фокусов пролиферации;
- IV стадия нарушение оттока секрета в единичных ацинарных структурах, составляющих пролиферативный центр, с их кистозным расширением;
- V стадия все ацинусы, формирующие пролиферативный центр, или подавляющее их большинство кистозно расширены, а выстилающий их эпителий атрофирован.
Такой путь развития пролиферативного процесса в железистом компоненте предстательной железы прослеживается в большинстве случаев. Однако возможны некоторые отклонения. Различные варианты этих отклонений носят название атипической гиперплазии. В термин атипическая гиперплазия заложена отнюдь не принадлежность этого процесса к онкологическим заболеваниям, а лишь подчеркнута атипичность развития самого гиперпластического процесса. По нашим данным, атипические формы железистой гиперплазии простаты встречаются в 8,7% всех случаев железистых гиперплазий.
Среди атипических форм железистой гиперплазии с наибольшей частотой встречается базальноклеточная гиперплазия. Ее частота составляет 86,3% всех атипических гиперплазий. При этой форме в отдельных пролиферативных центрах выявляются фокусы, в которых железистые структуры сформированы базальными клетками. Пролифераты из базальных клеток могут носить характер солидных тяжей, а могут проявляться в виде сегментарных пролифератов внутри ацинарных структур.
Другие варианты атипических гиперплазий встречаются значительно реже. Так, аденоз, следующая по частоте форма атипической гиперплазии, составляет 7,6% случаев атипических гиперплазий. При этой форме железистой гиперплазии в отдельных участках предстательной железы отмечается разрастание мелких железистых структур. Расположены эти железки хаотично и отделены друг от друга тонкими прослойками соединительной ткани. Если строма в фокусах аденоза значительно доминирует над паренхимой, то такой его вариант носит название фиброзирующегo аденоза.
Еще одной формой атипической гиперплазии является так называемая крибриформная гиперплазия, когда пролиферирующие клетки образуют подобие решетчатых структур. Эта форма встречается достаточно редко (2,4%) и требует дифференциальной диагностики с крибриформным (криброзным) раком предстательной железы.
Филлоидная гиперплазия имеет наименьшую частоту встречаемости (1,3%). Проявляется она формированием в ткани предстательной железы узких щелей, выстланных кубическим эпителием.
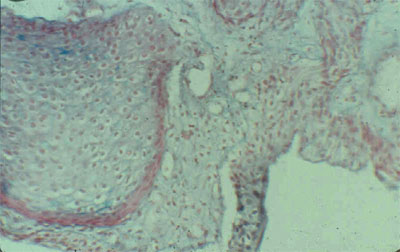
Рисунок 7. Плоскоклеточная метаплазия ацинарного эпителия. Окраска по Крейбергу. Х 100
Достаточно часто при гиперпластическом процессе в предстательной железе ацинарный эпителий подвергается плоскоклеточной метаплазии (рисунок 7). Этот вариант изменения железистого эпителия называют плоскоклеточной гиперплазией, хотя, по нашему мнению, правильнее называть ее железистая гиперплазия с плоскоклеточной метаплазией, пссксльку она характеризуется не атипическим развитием железистого эпителия простаты, а трансформацией одного вида эпителия в другой. Встречается плоскоклеточная гиперплазия в 56,8% от всех случаев железистой гиперплазии.
Еще одним вариантом мета пластического процесса является переходноклеточная метаплазия ацинарного эпителия. Встречается этот вид гиперплазии особенно редко: мы наблюдали его лишь в 0,06% случаев железистой гиперплазии.
При железистой гиперплазии могут существовать различные варианты атипической гиперплазии. Фокусы роста этих форм могут располагаться в различных отделах предстательной железы. Выделение атипических форм в отдельные группы обусловлено тем, что каждый из этих вариантов, по сути, является факультативным предраком. Следовательно, пациенты, у которых в предстательной железе обнаруживаются фокусы атипической гиперплазии, нуждаются в диспансерном наблюдении и составляют группу риска в отношении рака предстательной железы.
Описанные гиперпластические процессы в предстательной железе при ДГПЖ носят диффузный характер, т.е. распространяются по всему объему органа. Однако существует определенная закономерность в степени выраженности пролиферативного процесса в различных его отделах.
Необходимо отметить, что предстательная железа представляет собой достаточно однородный орган, который в норме состоит только из правой и левой долей, соединенных перешейком и разделенных бороздой, проходящей по задней поверхности. Перешейком предстательной железы называется участок, расположенный между местом вхождения в ее основание шейки мочевого пузыря спереди, а также правого и левого семявыбрасывающих протоков сзади. Этот перешеек при его гипертрофии рассматривают как среднюю долю предстательной железы [4]. Отходящие от ее капсулы соединительнотканные тяжи, образующие строму органа, располагаются между протоками ацинусов вместе с гладкомышечными волокнами. Именно эти фибромускулярные структуры разделяют железу на дольки, однако их величина и расположение настолько вариабельны, что принимать их за сформированные анатомические структуры нецелесообразно.
В ткани предстательной железы можно четко выделить 2-3 главные железы, располагающиеся в субкапсулярных отделах органа, вставочные или подслизистые железы, расположенные в интраму ральных отделах предстательной железы и слизистые или периуретральные железы.
Интенсивность пролифера тивного процесса в железистом компоненте простаты различна. Наиболее активно пролиферируют ацинарные клетки слизистых желез, менее активно пролиферируют ацинарные клетки вставочных (подслизистых) желез, а пролиферативная активность клеток ацинусов главных желез наиболее низкая. Естественно, что эта основная закономерность может подвергаться различным изменениям, но они являются лишь отклонением от правил. Проведенное нами исследование секционного материала лиц преклонного возраста, не страдавших урологическими заболеваниями, показало, что пролиферативный процесс развивается как в периуретральной, так и в субкапсулярной области. В последнем случае он может идти даже с опережающей интенсивностью. Однако эти пациенты никогда не обращаются за урологической помощью, поскольку развивающийся в субкапсулярной зоне пролиферативный процесс, как правило, не сопровождается нарушением мочеиспускания, по сравнению с теми пациентами, у которых пролиферативный процесс развивается преимущественно в периуретральной зоне, или в слизистых железах.
Приведенные выше данные позволяют обосновать отказ от термина аденома предстательной железы, поскольку он несет некоторый элемент порочности в выборе тактики лечения и понимании сути патологического процесса.
Во-первых, признав этот термин мы признаем возможность рецидивирования доброкачественной опухоли из железистого эпителия, которые рецидивируют крайне редко. Доброкачественная гиперплазия, в противоположность этому, обладает значительной способностью к рецидивированию.
Во-вторых, применение этого термина предопределяет отсутствие диффузного поражения органа, что имеет место при ДГПЖ.
Наконец, в-третьих, после удаления аденомы возможно восстановление функции, чего не может произойти при ДГПЖ.
Бесспорно, доброкачественная опухоль из железистого эпителия (аденома) может развиться в предстательной железе, но встречается она крайне редко. По нашим данным, основанным на 18 000 наблюдений, истинная аденома простаты была обнаружена лишь в 0,07%. Кроме того, следует отметить, что патогенез развития S гиперпластического и опухолевого процессов весьма различен. Различие это усиливается еще и тем, что гиперпластический процесс в предстательной железе носит выраженный дисгормональный характер.
Естественно возникает вопрос: для чего необходимо изучение морфологических изменений в предстательной железе при доброкачественной гиперплазии, что дает для клинической практики знание стадий морфогенеза этого заболевания? Ответ на него может в некоторой степени объяснить причины возникновения рецидивов ДГПЖ и ориентировать урологов в выборе тактики лечения.
Если при морфологическом исследовании ткани предстательной железы, предшествующем применению какого-либо метода лечения (спектр этих методов лечения в настоящее время необычайно широк), обнаруживаются пролиферативные центры I, II или III стадии развития, то врачклиницист получает достаточно хороший ориентир для выбора метода консервативной терапии. В данной ситуации очевидно, что сохранен тот субстрат, на который действуют препараты, обладающие 5-альфа-редуктазной активностью. С другой стороны, при трансуретральной электрорезекции предстательной железы у таких больных, особенно относительно молодого возраста, весьма велика вероятность развития рецидива ДГПЖ в будущем, поскольку этот метод лечения не обладает достаточной степенью радикализма. Кроме того, если в биоптате помимо типичных проявлений ДГПЖ обнаруживаются очаги атипической гиперплазии или фокусы различных вариантов ПИН (простатической интраэпителиальной неоплазии), то термальные методы лечения, по всей видимости, должны быть исключены, поскольку в данном случае речь идет о различных вариантах факультативного предрака или рака на месте (carcinoma in situ).
Присутствие в биоптатах пролиферативных центров IV или V стадий развития указывает на то, что применение консервативной терапии не приведет к желаемому результату. Эффективность лекарственных препаратов будет тем ниже, чем в большей степени будут выражены атрофические процессы. Вместе с тем наличие пролиферативных центров на этих стадиях развития практически исключает вероятность рецидива заболевания и позволяет надеяться на значительное субъективное улучшение состояния после оперативного вмешательства, поскольку трансуретральная электрорезекция простаты, помимо увеличения просвета уретры, приведет к декомпрессии значительного количества перерастянутых ацинусов в оставшейся части предстательной железы.
Обсуждая морфологические изменения в ткани предстательной железы при ДГПЖ, нельзя оставить в стороне два вопроса. Первый из них это воспаление в ткани предстательной железы при данном заболевании, второй другие процессы, способные имитировать изменения, характерные для ДГПЖ.
По нашим данным, в ткани предстательной железы при ДГПЖ в 96,7% случаев встречается воспалительная реакция, прежде всего в форме экссудативных (острых) форм воспаления.
Во-первых это интерстициальное воспаление, когда воспалительный экссудат распространяется по интерстицию (периканаликулярно). При этом варианте воспаления изолированный серозный экссудат практически не встречается. Чаще всего очаги серозного воспаления соседствуют с фокусами гнойного, что позволяет их расценивать как прогрессирование воспалительной реакции. Возможно формирование в ткани предстательной железы микроабсцессов.
Во-вторых наличие гнойного экссудата в просвете ацинусов (интраканаликулярное).
Продуктивные формы воспаления в предстательной железе при ее доброкачественной гиперплазии чаще всего встречаются в виде интерстициального процесса, а воспалительный инфильтрат локализуется либо в строме органа, либо периацинарно. Следует отметить, что при различных вариантах продуктивного воспаления в ткани предстательной железы, оно является ответной реакцией на некоторые патологические процессы: изменение физикохимических свойств секрета предстательной железы в результате его застоя, пролиферация ацинарного эпителия, ишемическое повреждение ткани простаты и ряд других патологических процессов.
Ключевые слова: предстательная железа, морфология, доброкачественная гиперплазия, стадирование.
ЛИТЕРАТУРА
- Структурные основы адаптации и компенсации нарушенных функций. / Под ред. Саркисова Д.С. М. Медицина. 1987. 445 с.
- Патологоанатомическая диагностика опухолей человека. / Под ред.Краевского Н.А., Смольянникова А.В., Саркисова Д.С. М. Медицина.1993. Т. 2, 686 с.
- Хэм Кормак Гистология / М. Мир. 1983. Т. 5. 294 с.
- Синельников Р.Д. Атлас анатомии человека., М. Медицина. 1968. Т. 2. 394 с
Источники: http://medicalplanet.su/oncology/255.html, http://www.medical-enc.ru/prostata/pathoanatomy-rak.shtml, http://ecuro.ru/article/morfologicheskie-izmeneniya-v-tkani-predstatelnoi-zhelezy-pri-dobrokachestvennoi-giperplazii










































