Ошибки при проведении биопсии простаты

Говоров А. В. В своем докладе провел анализ ошибок, которые встречаются при выполнении биопсии простаты.
По утверждению автора, при проведении первичной биопсии важно правильно определить показания к ее выполнению. Немаловажное значение имеет техника выполнения биопсии. При повторной биопсии необходимо определить группу пациентов, которым показана биопсия простаты.
Названы необходимые критерии при выполнении биопсии простаты:
- Адекватная подготовка кишечника
- Отмена антикоагулянтов и антиагрегантов.
- Необходимость выполнения биопсии простаты под ультразвуковым контролем.
- Обязательное применение антибактериальных препаратов.
Автор указал на то, что выполнение секстантной биопсии простаты оправдано только лишь при подозрении на рак предстательной железы в стадии Т3-Т4 и при уровне ПСА (Простатспецифического антигена) более 50 нг/мл.
Стандартным способом проведения биопсии простаты является выполнение биопсии из 10-12 точек, что при удовлетворительной переносимости процедуры повышает вероятность выявления рака простаты и позволяет более точно стадировать рак простаты и тем самым определить адекватный метод лечения.
Была описана методика проведения расширенной биопсии простаты.
По данным МГМСУ при выполнении повторной биопсии простаты с ПИН (Простатическая Интраэпителиальная Неоплазия) высокой степени рак предстательной железы выявлен в 43,6% случаев.
Были продемонстрированы новые технологии и перспективные направления в развитии данного направления. Авторы задаются вопросом: возможно ли в будущем выполнение биопсии простаты с использованием роботизированной техники?
Докладчик перечислил показания к выполнению повторной биопсии простаты — это:
- Малоинформативная первичная биопсия, выполненная из 6 точек и при отсутствии железистой ткани в препаратах.
- Уровень ПСА выше 10нг/мл.
- Высокая ПИН или ASAP.
В заключении было отмечено, что за последние 20 лет в развитии данного направления произошли революционные изменения, которые на сегодняшний день позволяют при использовании первичной биопсии по расширенной методике получить максимально высокие показатели выявляемости рака простаты и точности стадирования. Однако даже при выполнении расширенной биопсии предстательной железы нельзя быть уверенным в отсутствии рака простаты, поскольку в 18% случаев при повторной биопсии у данных пациентов выявляется рак. Также было сказано, что развитие новых малоинвазивных фокальных направлений в лечении рака простаты накладывает все более высокие и новые требования к выполнению биопсии простаты.
Ошибки диагностики и стадирования рака предстательной железы
С. Х. Аль-Шукри, С. Ю. Боровец, М. А. Рыбалов
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
В данном обзоре оцениваются преимущества и недостатки основных методов диагностики и стадирования рака предстательной железы, приводятся сведения о современных высокотехнологичных методах стадирования и номограммах. Рассматриваются причины ошибок, возникающих при диагностике и стадировании рака предстательной железы.
Ключевые слова: рак предстательной железы; диагностика; стадирование.
Введение
Повышение эффективности лечения рака предстательной железы (РПЖ) является одной из наиболее актуальных проблем современной урологии. В мире РПЖ занимает 3–4 место в структуре заболеваемости злокачественными новообразованиями. В России заболеваемость РПЖ в 2004 году составляла 6,9 %, а в 2009 году — уже 10,7 % [1]. При этом за последние три десятилетия возросло число мужчин, умерших от этого заболевания [2].
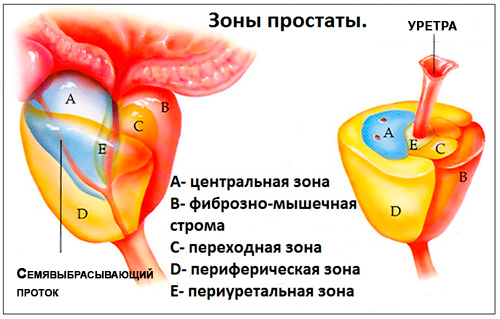
I. МЕТОДЫ ДИАГНОСТИКИ РПЖ
Методы диагностики рпж — включают оценку результатов пальцевого ректального исследования (ПРИ), определении уровня ПСА в плазме крови. Окончательный диагноз РПЖ может быть установлен только по результатам биопсии предстательной железы, которую целесообразно выполнять под ТРУЗ-контролем. При клиническом стадировании для уточнения границ местного распространения новообразования предстательной железы и для выявления местных и отдаленных метастазов в дополнение используют различные методы, позволяющие получить изображение: компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), сцинтиграфию костей скелета и др. Однако результаты этих методов могут быть интерпретированы ошибочно как в пользу гипо, так и гипердиагностики. Работы многих исследователей посвящены оптимизации скрининга и ранней диагностики РПЖ [3–5].
1.1. ПРИ. До внедрения в широкую клиническую практику ПСА, ПРИ было единственным методом диагностики РПЖ. Большинство злокачественных новообразований РПЖ располагаются в периферической зоне простаты и могут быть выявлены с помощью ПРИ, если их объем превышает 0,2 см 3. Положительная прогностическая ценность ПРИ варьирует от 4 % до 11 % у мужчин с уровнем ПСА от 0 до 2,9 нг/мл, и от 33 % до 83 % — от 3 до 9,9 нг/мл и выше [6]. В связи с тем, что оба этих метода имеют независимую друг от друга диагностическую ценность, рекомендовано применять их комбинацию.
1.2. ПСА и его производные. Несмотря на то, что уровень ПСА в плазме крови повышается при различных заболеваниях предстательной железы — РПЖ, доброкачественной гиперплазии предстательной железы (ДГПЖ) и простатите, ПСА остается практически единственным маркером, применяемым в целях ранней диагностики РПЖ. Однако единых общепринятых международных стандартов в отношении пороговых значений ПСА, которые могли бы использоваться для диагностики РПЖ, не существует [7]. Результаты недавнего исследования по профилактике РПЖ, проведенного в США, подтвердили, что у многих мужчин РПЖ может присутствовать, несмотря на низкий уровень ПСА крови [8] (см. табл. 1).
При использовании более высоких условных границ уровня ПСА (>4 нг/мл) для принятия решения о целесообразности проведении биопсии простаты повышается и риск пропустить клинически значимый РПЖ; в тоже время при снижении этого показателя ( 10 частота выявляемости РПЖ на превышает 8 % [12].
1.3. PCA3. Относительно новый и интенсивно исследуемый в настоящее время маркер — PCA3 (простатоспецифический некодирующий мРНК), который определяют в осадке мочи после массажа простаты. Этот маркер имеет более высокую чувствительность и специфичность по сравнению с ПСА, не зависит от объема простаты и наличия простатита у больного [13]. Сравнительно небольшое число опубликованных работ по анализу диагностической ценности этого маркера не позволяет рекомендовать его для широкого использования в клинической практике. В связи с этим в настоящее время этот маркер можно рассматривать как экспериментальный метод диагностики РПЖ.
1.4. ТРУЗИ. Классическая картина гипоэхогенного образования, расположенного в периферической зоне простаты, встречается не всегда, поэтому ТРУЗИне относят к методам, позволяющим достоверно определять наличие РПЖ. ТРУЗ-контроль получил широкое распространение при выполнении биопсии простаты.
1.5. Биопсия простаты. Биопсия предстательной железы является достоверным методом верификации диагноза РПЖ. Многими авторами были предложены различные методики выполнения этого исследования, отличающиеся по количеству и участкам расположения биопсийных вколов. При объёме ПЖ 30–40 см3 необходимо проводить биопсию не менее чем из 8 точек. С увеличением количества точек более 12, точность анализа существенно не изменяется [14]. На основании результатов Британского исследования по диагностике и лечению РПЖ была рекомендована биопсия из 10 точек [15].
II. МЕТОДЫ СТАДИРОВАНИЯ РПЖ
2.1. ПРИ. Принято выделять клиническое стадирование, основанное на данных ПРИ, определении уровня ПСА, рентгенологических, радиоизотопных и других клинических методах исследования, а также патологоанатомическое стадирование, которое становится возможным после морфологического анализа удаленной предстательной железы, семенных пузырьков и лимфатических узлов. Патологоанатомическое стадирование более точно позволяет оценить распространение болезни и судить о ее прогнозе. Наиболее важными патологоанатомическими прогностическим факторами после радикальной простатэктомии являются степень дифференцировки новообразования, позитивный хирургический край, экстракапсулярное распространение опухоли, ее инвазия в семенные пузырьки и метастазирование в тазовые лимфатические узлы. Сведения об ошибках патологоанатомического стадирования не включены в настоящий обзор литературы.
ПРИ позволяет определить не только наличие РПЖ, но и степень его местного распространения. Пальпируемая опухоль в простате — это признак, характерный для низкодифференцированного РПЖ (степень злокачественности по Gleason — 8–10 баллов). Чувствительность и воспроизводимость ПРИ весьма низкие, что приводит как к недооценке, так и к переоценке степени распространения РПЖ. Чувствительность метода при определении клинической стадии РПЖ не превышает 30 % [16]. Стадия рака простаты правильно диагностируется с помощью данного исследования менее чем в 50 % случаев [17].
2.2. ПСА. Более высокий уровень ПСА в плазме крови косвенно указывает на большую степень распространения РПЖ, но не позволяет достоверно предсказать ни клиническую, ни патоморфологическую его стадию [18, 19].
2.3. ТРУЗИ позволяет выявить только 60 % опухолей простаты, остальные не распознаются из-за эхогенности, сходной с таковой у окружающих здоровых тканях. При этом остаются недиагностированными более 60 % РПЖ на стадии рТ3 [20]. ТРУЗИ в комбинации с цветной допплерографией позволяет визуализировать проходящие через капсулу кровеносные сосуды, что типично при экстракапсулярном распространении новообразования [21, 22]. Однако эта методика имеет низкую воспроизводимость, в связи с чем ее относят к категории вспомогательных.
2.4. Биопсия простаты. По результатам биопсии простаты можно оценить степень местного распространения РПЖ, а также степень злокачественности новообразования в баллах по шкале Gleason. Процент пораженной ткани — наиболее надежный прогностический фактор риска инвазии опухоли в семенные пузырьки и экстракапсулярного распространения новообразования.
2.5. КТ и МРТ недостаточно надежно позволяют судить о степени распространения РПЖ, чтобы рекомендовать их как обязательные методы обследования. МРТ с эндоректальной катушкой позволяет более точно определить стадию РПЖ и прорастание опухоли в семенные пузырьки. Однако на фоне геморроидальных и воспалительных изменений ПЖ или после ее биопсии интерпретация данных может быть затруднена [9]. Сочетание контрастной МРТ и МРТ в Т2‑режиме усиления и применение МРТспектроскопии позволяет лучше верифицировать опухолевую ткань и диагностировать экстракапсулярное распространение опухоли [23].
Недостатки методов визуализации при РПЖ:
- Ложноотрицательные результаты из-за постбиопсийной крови.
- Артефакты от газа в прямой кишке, перистальтики.
- Ложноположительные очаги.
- Ложноотрицательные результаты ЭМРТ при РПЖ с инвазией в прямую кишку.
- Выявление РПЖ в центральной зоне.
- Невыявляемые очаги рака.
- Высокая зависимость от опыта рентгенолога. Пути решения:
- МРТ до биопсии или через 4 недели после нее.
- Подготовка пациента (микроклизма).
- Динамическое контрастирование.
- МРТ с поверхностной катушкой.
- МР-спектроскопия.
- Субспециализация.
2.6. Высокотехнологичные методы стадирования РПЖ. К новым перспективным методам, позволяющим получить изображение, можно отнести ПЭТ, при помощи которого диагностируют около 70 % РПЖ на стадии рТ2 и pT3a‑4 [9]. При этом очаг рака и микрометастазы 100 нг/мл практически у всех больных имеют место отдаленные метастазы РПЖ [29].
III. Причины ошибок при диагностике и стадировании РПЖ
Среди причин, приводящих к ошибкам при диагностике и стадировании РПЖ можно выделить субъективные и объективные.
- Недостаточная квалификация специалистов.
- Неправильная интерпретация данных обследования.
- Отсутствие высоко специфичных методов диагностики.
- Недостаточное использование современных методов диагностики.
- Неиспользование стандартных рекомендаций, предложенных Европейской ассоциацией урологов.
В заключении следует отметить, что в последние годы предпринимаются попытки совершенствования методов ранней диагностики и стадирования РПЖ.
Однако существует потребность в создании новых, более точных методов, позволяющих выявлять клинически значимый РПЖ. К перспективным методам, позволяющим оптимизировать процессы диагностики и стадирования, можно отнести ПЭТ/КТ, диффузионную МРТ, МР-спектроскопию, динамическую МРТ с повышением контраста. Необходима дальнейшая разработка специфичных для РПЖ радиофармпрепаратов. Кроме того, важна унификация при интерпретации полученных данных — использование рекомендаций Европейской ассоциации урологов.
Список литературы
- Чиссов В. И., Русаков И. Г. Заболеваемость раком предстательной железы в Российской Федерации // Экспериментальная и клиническая урология. — 2011. — № 2–3. — С. 6–7.
- Quinn M., Babb P. Patterns and trends in prostate cancer incidence, survival, prevalence and mortality. Part I: international comparisons // B. J. U. Int. — 2002. — Vol. 90, N 2. — P. 162–173.
- Ilic D., O’Connor D., Green S., Wilt T. J. Screening for prostate cancer: a Cochrane systematic review // Cancer Causes Control. — 2007. — Vol. 18, N 3. — P. 279–285.
- Andriole G. L., Crawford E. D., Grubb R. L. 3rd. et al. Mortality results from a randomized prostate-cancer screening trial // N. Engl. J. Med. — 2009. — Vol. 360, N 13. — P. 1310–1319.
- Schröder F. H., Hugosson J., Roobol M. J. et al. Screening and prostate-cancer mortality in a randomized European study // N. Engl. J. Med. — 2009. — Vol. 360, N 13. — P. 1320–1328.
- Schröder F. H., van der Maas P., Beemsterboer P. et al. Evaluation of the digital rectal examination as a screening test for prostate cancer. Rotterdam section of the European Randomized Study of Screening for Prostate Cancer // J. Natl. Cancer Inst. — 1998. — Vol. 90, N 23. — P. 1817–1823.
- Semjonow A., Brandt B., Oberpenning F. et al. Discordance of assay methods creates pitfalls for the interpretation of prostatespecific antigen values // Prostate. — 1996. — Suppl. 7. — P. 3–16.
- Thompson I. M., Pauler D. K., Goodman P. J. et al. Prevalence of prostate cancer among men with a prostate-specific antigen level
Биопсия предстательной железы и ее последствия
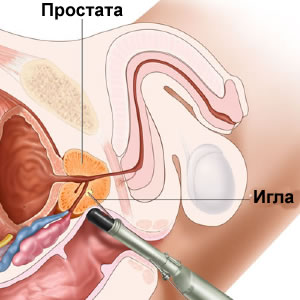
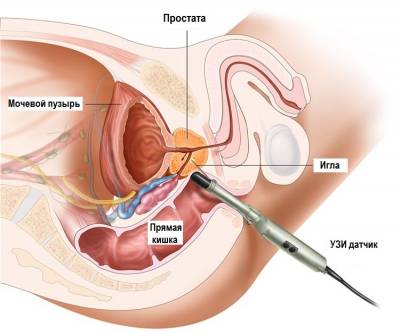
Достоверность ракового поражения предстательной железы подтверждается только морфологическим исследованием. Для получения ткани используется биопсия, которая облегчается доступностью предстательной железы, совершенством ультразвуковых и биопсийных аппаратов с минимальной опасностью возможных осложнений.
Биопсия предстательной железы совершенствовалась от «слепой», под контролем пальца, до пункционной и, наконец, взятию кусочков тканей с использованием ТрУЗИ. Данная техника является теперь одной из наиболее общих процедур в повседневной работе уролога.
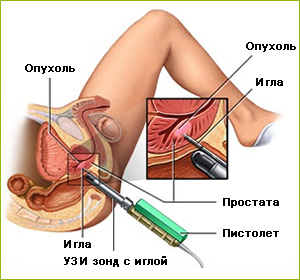
Несмотря на то, что большинство пациентов при проведении биопсии испытывают чувство дискомфорта, биопсию предстательной железы до недавнего времени повсеместно выполняли без анестезии. В современных условиях изменились подходы перед и во время проведения биопсии: очистительная клизма считается необязательной, в то время как введение антибиотиков с профилактической целью — необходимым и используется как при промежностном, так и трансперинеальном подходах. Локальная анестезия уменьшает болевой дискомфорт у пациентов. Чем больше точек для биопсии, тем более высока потребность в анестезии.
Следует отметить, что в настоящее время урологи озабочены большим количеством направлений пациентов, у которых лабораторно обнаруживается повышение уровня ПСА. Имея такое направление, пациент вправе интересоваться риском наличия у него рака предстательной железы, и он охотно соглашается па диагностические процедуры.
Вряд ли кому-либо из урологов придет в голову мысль начинать лечение без проведения биопсии и последующего морфологического подтверждения рака предстательной железы. Следовательно, данный вид злокачественного новообразования в клинике устанавливается исключительно гистопатологически. Биопсия простаты является необходимой диагностической процедурой.
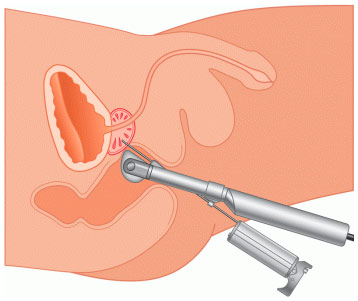
Из двух известных подходов в последнее время предпочтение отдается трансректальному, поскольку этим доступом можно получить ткань практически из всех зон предстательной железы. Облегчается техника взятия ткани ультразвуковым наведением.
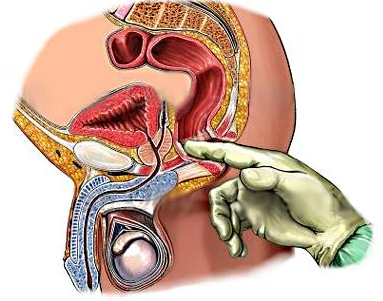
Биопсия предстательной железы в настоящее время выполняется у всех пациентов с подозрением на рак. При пальпируемом уплотнении, обусловленном опухолевым очагом, трансректальная биопсия под контролем пальца в опытных руках является щадящим, метким и результативным методом взятия кусочка ткани для морфологического исследования. По данным J.E.Altwein, положительный результат при наличии уплотнения констатируется в 91 %, а если имеется плотный очаг или узел, отрицательные результаты составляют 83 %.
В последние годы прослеживается отчетливая тенденция распознавания ранних форм рака предстательной железы. Поскольку достоверность серологических значений ПСА весьма вариабельна, особенно на уровне до 10 нг/мл, и зависит от объема опухоли либо подвержена влиянию воспалительных процессов, место биопсии в диагностике начальной стадии рака трудно переоценить. Зародившись в эпителиальных ходах предстательной железы, начальные очаги клинически остаются «немыми», они недоступны пальпации и ультразвуковому сканированию. В этих условиях бессистемным взятием материала для морфологического исследования можно пропустить очаги начальной атинии, либо явные скопления раковых клеток. Для охвата всех зон предлагаются многочисленные варианты использования точек, основанные на представлениях о топографии зон предстательной железы.
В практическом плане у пациентов со значением ПСА выше 4 нг/мл и наличием подозрительных очагов, обнаруженных при трансректальном, надлонном или промежностном У3-исследовании, в обязательном порядке проводится тонкоигольная биопсия. Наиболее результативную информацию можно получить путем взятия ткани как из лоцируемых подозрительных участков, так и из шести точек — по три в каждой доле.
Известно, что типичным ультразвуковым отражением ракового процесса является гипоэхогенность.
На основании новейших технических модальностей типа цветного Допплера, энергетического Допплера и трехмерного отображения J.Veltman отмечает, что большинство опухолей предстательной железы визуализируются как гипоэхогенная область отличная от нормальной гомогенной изоэхогенной паренхимы. Небольшие опухолевые узлы довольно часто не сопровождаются феноменом гипоэхогенности, и их трудно выделить при проведении ультразвуковых исследований. Кроме того, много ранних стадий рака изоэхогенны, поэтому также не различимы с окружающей мягкой тканью. В этих случаях должны применяться другие технологии забора тканей для морфологической верификации. Наибольшее распространение получила методика из шести точек, так называемая «секстантная» биопсия, которая многими специалистами признается как стандартная. Показания к биопсии простаты должны исходить из уровня ПСА, обнаруженных изменений при пальцевом ректальном исследовании или возникших подозрениях при проведении ультразвукового исследования. Подтвердить морфологически рак путем взятия образца ткани из наиболее уплотненного очага можно одной пункцией. Не следует рекомендовать проводить всем пациентам мультифокальную биопсию. Она показана, как правило, при пальпируемых узлах, явных ультразвуковых очагах и при повышении ПСА более 4 нг/мл.
О. Б. Лоран подтверждает, что проведение биопсии под пальцевым контролем оправдано у определенной категории пациентов.
Частота выполнения и результативность повторной биопсии
Встречаемость ПИН как самостоятельной формы предракового состояния невелика и составляет, по данным наших урологических центров, менее 1 % в биопсийных образцах. Несколько чаще морфологи делают заключение: «Есть участки, подозрительные на рак». При личных контактах на конкретный вопрос: «Имеется все-таки рак или нет?» — они чаще всего молчаливо пожимают плечами или отвечают дипломатично: «Поживем-увидим». Такой ответ заставляет насторожиться как врача, так и пациента, и он является прямым показанием к проведению повторной биопсии. Показания к данному методу возникают и в других ситуациях, прежде всего там, где сохраняется уровень сывороточного ПСА> 10 нг/мл. Опасения пропустить рак у такого пациента не безосновательны, и ему тоже необходима повторная биопсия.
Существуют многочисленные рекомендации, касающиеся сроков проведения повторной биопсии, но все они, так или иначе, указывают в среднем на 3-месячный интервал. Вместе с тем, ведущие специалисты полагают, что при наличии в биоптатах ПИН высокой степени повторную биопсию следует проводить немедленно.
При проведении повторной биопсии на результативность заключений влияют:
достаточность объема ткани в получаемых образцах предстательной железы;
количество изъятых столбиков;
качество проведенной процедуры;
Перечисленные факторы оказывают значительное влияние на частоту выявления заболеваний, ассоциирующихся с риском рака простаты.
Частота обнаружения рака простаты при повторных биопсиях после первичного диагноза ПИН высокой степени составляет от 20 до 90%. В то же время при повторных биопсиях на основе заключений об «атипичных» и «подозрительных на малигнизацию» изменениях этот показатель составляет от 30 до 60 %.
Л. М. Гориловский и М. Б. Зингеренко в морфологическом материале, полученном при повторной биопсии, обнаружили аденокарциному > 0,1%. Авторы подтверждают, что при повторной биопсии простаты и наличии ранее выявленной ПИН высокой степени, частота обнаружения в последующем аденокарциномы простаты составляет 51,5%.
Выявляемость рака простаты в повторных биопсиях зависит от эффективности первичной биопсии.
Если, например, при первичной биопсии рак был пропущен, то повторная повышает частоту выявляемости рака. Если осторожный патолог воздерживается от заключительного диагноза злокачественно, заболевания в первичной биопсии, то в последующих биопсиях он профессионально и уверенно дает заключение о диагнозе рака простаты. И, естественно, при многочисленных биопсиях у мужчин с повышенным уровнем ПСА, подозрительными участками уплотнения при пальцевом ректальном исследовании, эхонегативными зонами, вероятность выявления рака значительно повышается.
Если повторная биопсия выполняется у пациентов с очагами изолированной ПИН, то локализация рака простаты не всегда может совпадать с участком, подозрительным на малигнизацию. И наоборот, стратегия повторных биопсий после первичного установления диагноза «подозрительных изменений на малигнизацию» диктует необходимость тщательного выполнения биопсии в той части простаты, где обнаружен подозрительный участок. Некоторые исследователи считают, что нахождение ПИН в 6-точечной пункционной биопсии следует рассматривать как предраковое состояние с большой долей вероятности развития в последующем рака.
Следует помнить, что ложноположительные результаты, которые иногда присутствуют в заключениях патологов, могут значительно повлиять на качество жизни пациентов вследствие неоправданного стресса, излишне активного лечения и связанных с ним осложнений. Без сомнения, по любым соображениям, в том числе медицинской этики, ложноположительных результатов следует избегать.
Некоторые специалисты выражают беспокойство по поводу неоправданного выполнения повторной биопсии у ряда пациентов. На вопрос, когда следует брать биопсию, нет однозначно точного ответа, хотя процедуру выполняют сейчас очень широко, и она может сопровождаться негативными последствиями. Согласно мнению J.Vanderkerken, в будущем более точные прогностические исследования рака простаты повысят качество ответа на вопрос, когда необходимо брать биопсию. Большое число индикаторов, используемых в настоящее время, будут заменены одним очень хорошо прогнозирующим исследованием, чтобы уменьшить количество истинных отрицательных биопсий. С другой стороны, результаты гистологического исследования должны быть точными и однозначными, чтобы не приводить к необязательным биопсиям с сопутствующими осложнениями.
Осложнения биопсии
Несмотря на относительную простоту биопсии как диагностической процедуры у некоторых пациентов могут возникать осложнения, вызывающие определенный дискомфорт. О частоте, видах и тяжести последних, сообщения ограничиваются отрывочными сведениями. Как правило, их число возрастав пропорциях от количества используемых точек биопсии и, естественно, оно будет выше при стремлении получить 12 или 18 пункционных цилиндров. J. Dorsman и G. Stachler различают «большие» и «малые» виды осложнений, относя к первым макрогематурию и гемоспермию.
Согласно наблюдениям, гематурия поле трансректальной биопсии отмечается у большинства больных, хотя интенсивность ее весьма вариабельна — от наличия слабого окрашивания до обнаружения небольших сгустков крови. У многих пациентов гематурия исчезает быстро и спонтанно, не требуя каких-либо специальных мер. Рекомендаций периодического использования пузыря со льдом на область промежности оказывается вполне достаточно, чтобы прекратилось выделение крови в течение 5-6 суток. Но есть пациенты, у которых такой прием оказывается недостаточным, и при выраженной макрогематурии приходится применять более активные меры. В качестве упреждения кровотечений возможен временный уретральный катетер. Исключительно редко возникает потребность в систематическом промывании мочевого пузыря. Р. М. Desmond при ретроспективном анализе 670 пациентов после трансректальной биопсии обнаружил у 0,1% тампонаду мочевого пузыря, которую ликвидировали с помощью эвакуатора.
В качестве факторов риска развития макрогематурии следует отметить связь с диаметром биопсийной иглы. Дискутируется и вероятность увеличения частоты макрогематурии от количества точек, из которых в предстательной железе получают ткань для гистологического исследования. Эти вопросы достаточно спорны, поскольку Z. V. Rodriguez и М. К.Terris не обнаружили прямой зависимости, изучая частоту осложнений у лиц с предшествующей пиурией, приемом гемостатических средств, объемом предстательной железы и локализацией участков биопсии.
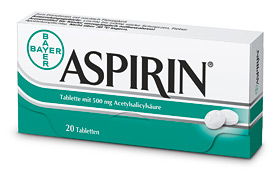
Хотя и невозможно с достоверностью предсказать вероятность макрогематурии после биопсии и выявить факторы риска, J.Dorsam и G.Stachler рекомендуют за 7-8 дней перед планируемой манипуляцией воздержаться от приема лекарств, в частности аспирина, понижающих свертываемость крови. Необходимо также учитывать и показатель числа тромбоцитов.
Наиболее беспокоящим пациента оказывается сам факт гемоспермии, и в этом плане профилактическим снятием проблемы становится разъяснение ему до биопсии такого варианта «легкого» типа осложнений.
Еще одним видом осложнений после трансректальной биопсии является кровотечение из заднего прохода, которое наблюдается от 0 до 37 %. Как правило, данное осложнение, выраженность которого у большинства больных бывает незначительным, заканчивается спонтанно. В качестве упреждающего приема следует после извлечения пункционной иглы прижать пальцем место прокола передней стенки прямой кишки. Для остановки кровотечения пользуются различными субстанциями. Наилучшей профилактикой осложнений при биопсии предстательной железы, является тщательный учет имеющихся изменений и соблюдение принципа аккуратной техники исполнения.
Наиболее серьезными и жизненно опасными осложнениями биопсии являются инфекционно-воспалительные процессы — острый простатит и сепсис. Частота одного и другого, в целом, невелика: менее 5% и менее 1% соответственно. Однако всегда необходима профилактика этих осложнений путем приема за сутки до биопсии либо тетрациклинового антибиотика, либо фторхинолонового препарата, которые целесообразно назначать еще на трое суток после процедуры.
Источники: http://doc.uroline.ru/meetings/3_oncourology_2008/003.html, http://www.uroweb.ru/article/oshibki-diagnostiki-i-stadirovaniya-raka-predstatelnoi-zhelezy, http://doctoroff.ru/biopsiya-predstatelnoy-zhelezy












































