Расшифровка результатов биопсии простаты: норма и отклонение
Гистологическое исследование биологического материала, который берется в ходе биопсии, позволяет подтвердить или опровергнуть наличие в тканях раковой опухоли. Сегодня эта методика активно используется в урологии с целью диагностики онкологии предстательной железы. Результаты биопсии простаты предоставляются медицинским центром, который проводил забор материала. Если обычный пациент получит их на руки, с высокой долей вероятности можно сказать, что сам он в них не разберется. На самом деле, читать расшифровку не так сложно, нужно лишь предварительно ознакомиться с базовой информацией о направлении.
Содержание статьи
Показания к проведению биопсии простаты и преимущества методики
 Проведение биопсии предстательной железы показано при подозрении на формирование ракового образования в теле органа. В ходе манипуляции собираются пораженные и здоровые ткани железистой массы, которые подвергаются лабораторным исследованиям. Полученные результаты не только подтверждают присутствие рака в организме, но и предоставляют информацию о степени агрессивности недуга. Это позволяет подобрать оптимальный вариант лечения опухоли, снизить вероятность ее распространения на другие системы.
Проведение биопсии предстательной железы показано при подозрении на формирование ракового образования в теле органа. В ходе манипуляции собираются пораженные и здоровые ткани железистой массы, которые подвергаются лабораторным исследованиям. Полученные результаты не только подтверждают присутствие рака в организме, но и предоставляют информацию о степени агрессивности недуга. Это позволяет подобрать оптимальный вариант лечения опухоли, снизить вероятность ее распространения на другие системы.
Чаще всего диагностическая манипуляция назначается в результате выявления тревожных симптомов или плохих результатов анализов. Врач может направить пациента на биопсию при выявлении узелков или уплотнений в простате в результате проведения ректального пальцевого осмотра. Повышенный уровень лейкоцитов или антигенов в моче, завышенные показатели ПСА в крови – также могут служить показаниями к забору биологического материала. В некоторых случаях исследование проводится на фоне течения других патологических состояний предстательной железы, чтобы исключить потенциальные риски.
Точность результатов – всего одно из многочисленных преимуществ диагностического подхода. Он проводится в амбулаторных условиях, требует минимальной подготовки и имеет минимальный срок восстановления. Благодаря ему можно отличить рак от гиперплазии простаты и быстрее начать профильное лечение. Если все сделать правильно, то с помощью биопсии можно диагностировать рак на самой ранней стадии его развития, что повышает вероятность благоприятного исхода.
Моменты, которые могут повлиять на результаты
Чтобы получить максимально точные результаты биопсии простаты, необходимо учесть несколько нюансов организации и проведения процедуры. Их игнорирование может привести к низкой информативности итогов. Это чревато постановкой ошибочного диагноза или пропуском патологии.
Основные правила подготовки к биопсии:
- Врач должен получить список всех медикаментов, натуральных или народных препаратов, которые пациент принимает или принимал в недавнем прошлом.
- Специалиста нужно уведомить о наличии аллергии и недавно перенесенных заболеваниях.
- За 10 дней до процедуры прекращается прием антикоагулянтов, иначе можно спровоцировать кровотечение. Если были зафиксированы какие-то проблемы со свертываемостью крови, в день сеанса этот компонент должен быть проверен.
- Нередко перед проведением биопсии мужчине предлагается пропить короткий курс антибиотиков для снижения риска инфицирования тканей.
- Сегодня биопсия чаще всего проводится под контролем УЗИ, но в некоторых случаях с той же целью используется аппарат МРТ. Такой подход требует снять все металлические предметы, врач должен быть осведомлен о наличии металлических протезов, кардиостимулятора.
- Перед проведением биопсии мужчине положен лишь легкий ужин. За пару часов до манипуляции ему ставится очистительная клизма.
Современные способы сбора и обработки материала практически исключают возникновение сложностей в технической части диагностики. Любые возникшие проблемы обычно являются результатом неправильной подготовки мужчины к процедуре или низкой квалификации специалиста.
Как долго ждать расшифровку биопсии?
Гистологический анализ тканей простаты занимает не так много времени, как думают многие. В среднем с момента сбора материала до получения расшифровки проходит 5-7 дней. Этот период может незначительно увеличиваться под влиянием ряда внешних факторов.

В частности, необходимость проведения иммуногистохимического исследования увеличивает базовые сроки. Передача собранного сырья в удаленную лабораторию или работа с особенно сложным случаем тоже могут добавить к стандарту несколько дней. Все эти моменты следует уточнить в выбранной клинике заранее, это еще и позволит оценить профессионализм ее работников.
Расшифровка по шкале Глисона
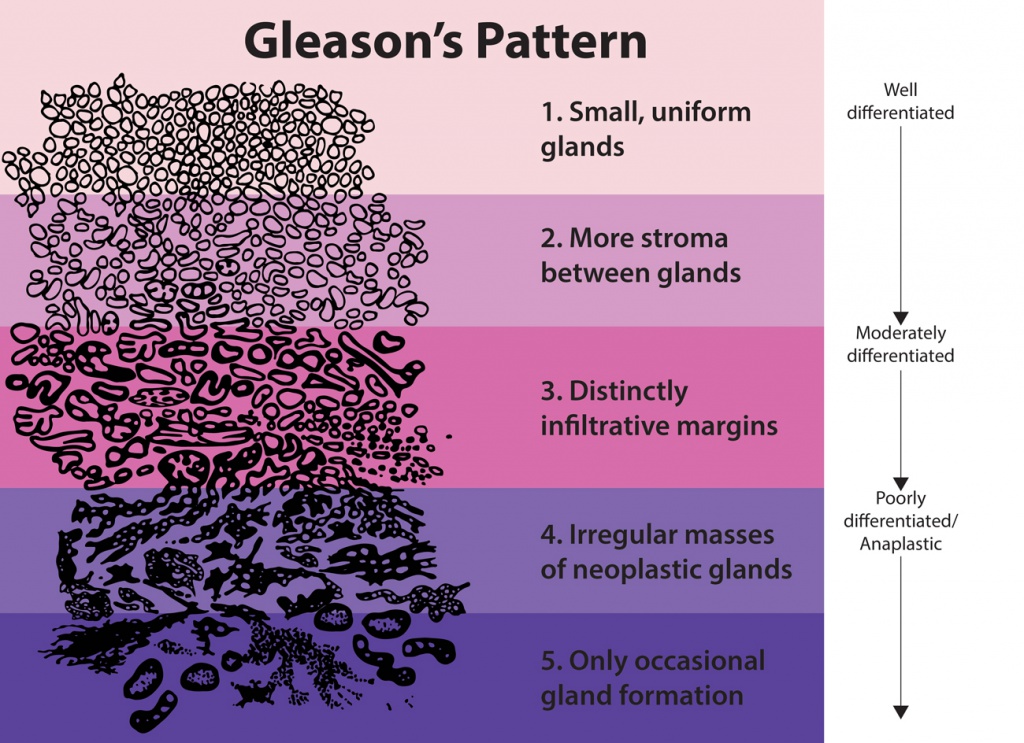
В 70-х годах прошлого века американский врач Дональд Глисон разработал шкалу оценки состояния тканей предстательной железы для постановки дифференциального диагноза. Она используется и сегодня в качестве основы процесса диагностирования онкологии простаты. С ее помощью анализируется состояние тканей и проводится расшифровка результатов.
Базовая информация по технологии
Шкала Глисона состоит из пяти ступеней, каждая из которых соответствует определенной степени злокачественности клеток. Гистолог анализирует собранные образцы и выбирает из них два самых злокачественных. Каждому из экземпляров присваивается своя оценка по шкале от 1 до 5, где 1 – наименее измененные данные, а 5 – показатель максимальной злокачественности. Эти 2 показателя суммируются и получается сумма Глисона – ее показатель может находиться в пределах от 2 до 10, указывая на степень агрессивности болезни.
Примечательно, что первая цифра анализа соответствует образцам, составляющим больше половины изученного объема. Вторая будет представлять меньшую часть исследуемого материала. Получается, что формула 2+3 будет выглядеть менее агрессивной, чем 3+2 из-за соотношения компонентов. Поэтому в расчет следует принимать не только сам результат, но и положение слагаемых в итоговой таблице.
Правила чтения показателей
Рассматривая результаты биопсии простаты, нормой можно называть показатель в 2 единицы. Он указывает на присутствие в образце исключительно здоровых клеток. В случае выявления показателя вплоть до 6 единиц ставится низкая степень агрессивности тканей образования. Цифра 7 указывает на среднюю степень тяжести ситуации. Результат в 8-10 единиц свидетельствует о высоком уровне агрессивности раковых клеток.
Каждый из исходов требует особого подхода к планированию дальнейших действий:
- Низкая степень (6 и меньше). Возможны самые разные способы лечения опухоли. В ряде случаев врачи даже рекомендуют немного подождать и последить за динамикой. К выжидательной терапии прибегают только при условии, что биопсия выявила менее двух столбиков с показателем поражения не более 50%. Риск роста и распространения рака низкий. Пациент должен регулярно сдавать кровь на ПСА, проходить ректальное пальцевое обследование, УЗИ, биопсию, МРТ.
- Средняя степень (7). Указывает на вероятность распространения опухоли на другие органы и системы, но при уровне ПСА менее 20 нг/мл она довольно низкая. На этой стадии могут быть использованы медикаменты, лучевая терапия, хирургическое удаление новообразования. Выбор оптимального варианта воздействия зависит от возраста пациента, наличия у него противопоказаний и сопутствующих патологий.
- Высокая степень (8-10). Агрессивный сценарий течения онкологии. Болезнь может в любой момент распространиться на ткани за пределами предстательной железы. Лечение требуется немедленное и комплексное, зачастую, агрессивное.
. Независимо от результатов исследования, только врач может решить, какие методы диагностики и варианты лечения могут быть использованы в конкретном случае. Любые самостоятельные действия несут большие риски и могут серьезно навредить.
Полученная расшифровка биопсии не является руководством к действию для людей, которые ничего не понимают в онкологии
Специфика иммуногистохимического исследования
 Данное направление не входит в базовый вариант проведения гистологического обследования материала, его проводят дополнительно. Подход очень важен в случае необходимости проведения дифференциальной диагностики рака. Иногда бывает сложно отличить злокачественную аденокарциному от доброкачественной опухоли, которая своим составом и поведением похожа на онкологию. Также этот технологический подход позволит выделить раковое поражение простаты и не принять его за рак других органов, например, толстого кишечника.
Данное направление не входит в базовый вариант проведения гистологического обследования материала, его проводят дополнительно. Подход очень важен в случае необходимости проведения дифференциальной диагностики рака. Иногда бывает сложно отличить злокачественную аденокарциному от доброкачественной опухоли, которая своим составом и поведением похожа на онкологию. Также этот технологический подход позволит выделить раковое поражение простаты и не принять его за рак других органов, например, толстого кишечника.
Патоморфологическая расшифровка онкологии
С помощью классификации патологического процесса по системе TNM специалисты устанавливают не только размеры опухоли и степень поражения простаты. Она позволяет оценить стадию вовлеченности в болезнь лимфатических узлов, наличие или отсутствие метастазов.
Значение Т-показателя
Кодировка, которая обозначает первичную опухоль. Знак Т1 указывает на минимальные размеры образования. Оно не выявляется при пальцевом исследовании предстательной железы или при использовании различных подходов визуализации тканей. И все же в ходе гистологического исследования массы выявляется наличие раковых клеток. Обозначение Т2 свидетельствует о значительных размерах опухоли, которая способна занимать не менее одной доли пораженного органа. Иногда уже на этой стадии поражение охватывает обе доли простаты.
Код Т3 ставится в случаях, когда рак выходит за пределы железы и прорастает в ее капсулу. Также на этой стадии он может затрагивать семенные пузырьки. В случае присутствия обозначения Т4 речь идет уже об обширном распространении онкологии на ткани, расположенные рядом с предстательной железой.
Значение N-показателя
Это обозначение отвечает за степень поражения лимфатических узлов. Если за буквой следует 0, это указывает на чистоту образований. Обозначение N1 характерно для поражения всего одного лимфатического узла регионарного плана. Его диаметр не может превышать 2 см. Кодировка N2 используется при вовлеченности в патологический процесс не менее двух лимфоузлов, диаметр которых составляет от 2 до 5 см. Последний показатель – N3 – свидетельство поражения лимфатических узлов в диаметре более 5 см.
Значение М-показателя
Для этой части кодировки может быть характерен только один из двух показателей. Цифра 0 используется при локализации патологического процесса. Он не распространяется дальше лимфатических узлов регионарного типа, если они и поражены. Цифра 1 свидетельствует о распространении метастазов. Она не зависит от того, какие именно органы поражены, в каком количестве и объеме.
В каком виде предоставляются результаты?
Все результаты проведенной биопсии предстательной железы вносятся в специальное заключение, представленное в виде таблицы. Если в ходе исследования гистологом было выявлено злокачественное новообразование, он обязан указать всю информацию, полученную о нем. В расшифровке гистологии можно найти определение типа опухоли, формулу и сумму Глисона, информацию по распространенности онкологии и ее локализации. Важным показателем являются данные о хирургическом крае образования, по которым можно спрогнозировать вероятность рецидива. Указывается наличие поражения лимфатических узлов и нервов.
Опытный специалист, получив составленный гистологом документ, сможет подтвердить или исключить вероятность наличия рака. Иногда данные оказываются спорными, тогда требуется повторное проведение манипуляции. Расшифровка анализа позволяет получить полное представление и патологии, ее типе и локализации. Эти данные необходимы для планирования схемы лечения, при которой риск рецидива будет минимальным.
Кажется, что читать предоставленную информацию не так сложно, но лучше все же не заниматься этим самостоятельно, а довериться профессионалу. Случается, что в документ закрадывается ошибка, очевидная онкологу или урологу, а пациенты ее не видят и начинают переживать раньше времени.
Рак предстательной железы — гистологические формы
В настоящее время существует тенденция к увеличению заболеваемости раком предстательной железы. Чаще стали болеть мужчины до 55 лет и чаще стали встречаться агрессивные типы рака предстательной железы. В современной онкологии выделяют несколько гистологических типов рака предстательной железы, при этом все они успешно поддаются лечению и имеют относительно благоприятный прогноз.
Аденокарцинома предстательной железы
Самым часто встречающимся типом рака предстательной железы является аденокарцинома предстательной железы.
Аденокарцинома предстательной железы встречается в 90% всех диагностируемых случаев рака предстательной железы. По своей структуре она бывает:
3. Крибриформной и
Все они подразделяются по степени злокачественности, по-другому это называется «дифференцировка по шкале Глисон (Gleason)». Эта дифференцировочная шкала применима только для аденокарцином.
Соответствие между показателем суммы по Gleason и степенью дифференцировки аденокарциномы (G):
-
Gleason Х – означает, что дифференцировка опухоли по шкале Глисон не определима.
Gleason score от 2 до 6 – означает, что опухоль представлена высокодифференцированной аденокарциномой. Это говорит о низкой агрессивности и незначительной клеточной анаплазии в опухоли. Такие аденокарциномы предстательной железы имеют хороший прогноз и обозначаются символами G1.
Gleason score от 7 до 8 – означает, что опухоль представлена умеренно-дифференцированной аденокарциномой. Это говорит о средних показателях злокачественной активности опухолевой ткани. Умеренно-диференцированные аденокарциномы предстательной железы имеют относительно благоприятный прогноз и обозначаются G2.
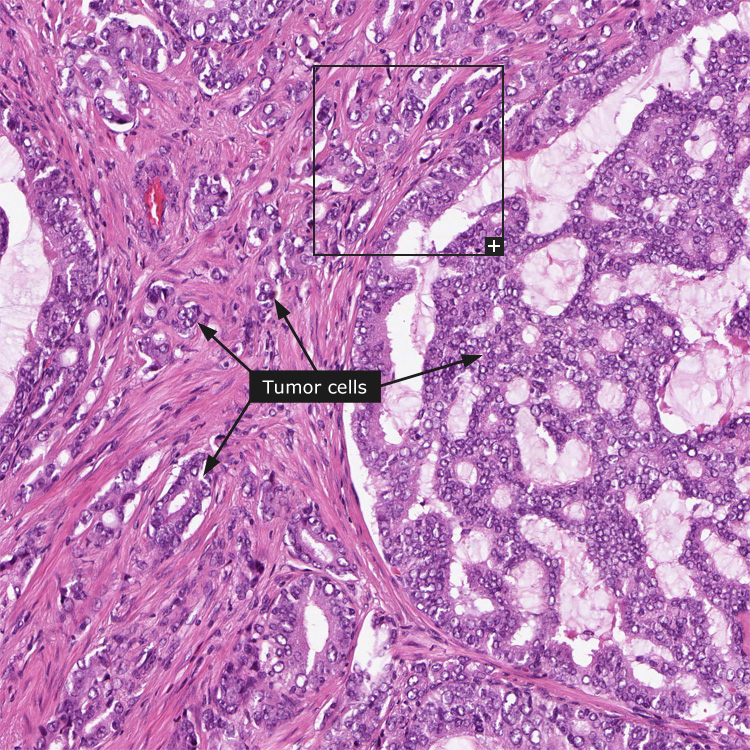
Остальные 20% злокачественных опухолей предстательной железы делят между собой такие гистологические типы рака как:
- Переходно-клеточный рак предстательной железы,
- Плоскоклеточный рак предстательной железы и
- Саркоматоидный рак предстательной железы.
Они поддаются противоопухолевому лечению хуже, чем аденокарциномы, но в настоящее время создается множество орфанных препаратов, направленных на лечение редких типов опухолей предстательной железы.
Гистологические особенности рака предстательной железы
Прилепская Е.А., Ковылина М.В., Говоров А.В., Васильев А.О., Садченко А.В., Пушкарь Д.Ю.
В настоящее время золотым стандартом диагностики рака предстательной железы (РПЖ) является гистологическая оценка биоптатов, полученных при трансректальной тонкоигольной мультифокальной биопсии предстательной железы (ПЖ) под контролем ультразвукового исследования [1,2,3]. Биоптаты ПЖ являются одним из самых сложных материалов для гистологической оценки. Морфологическая идентификация минимального фокуса аденокарциномы представляет значительную сложность в связи с необходимостью дифференциальной диагностики микрофокуса аденокарциномы с большим количеством доброкачественных состояний.
В настоящее время широко распространена биопсия из 10-14 точек [4,5]. В ряде случаев при наличии в анамнезе пациента простатической интраэпителиальной неоплазии или атипической мелкоацинарной пролиферации выполняется сатурационная биопсия ПЖ. Несмотря на то, что накоплен немалый опыт выполнения биопсии ПЖ в некоторых учреждениях биоптаты из левой и правой долей погружаются в два, отдельно маркированных, контейнера. Соответственно, при работе с гистологическим материалом в лаборатории биоптаты из одной доли помещаются в один блок и, таким образом, на микропрепарате оказывается несколько (от 3 и больше) фрагментов ткани ПЖ. Множество столбиков в одной кассете приводит к неравномерной заливке парафином биопсийного столбика и может вызвать потерю значительного количества материала для гистологического исследования и к большому количеству артефактов. Европейской и Американской ассоциациями патологов рекомендовано размещение на микропрепарате не более одного столбика ткани. Это не только позволяет сохранить длину биоптата и свести к минимуму количество артефактов, но и помогает спланировать постановку игл при брахи- и (или) криотерапии, решить вопрос об объеме предстоящей операции или спланировать ход повторных биопсий с прицельным забором большего количества фрагментов [6-10].
Следующим этапом работы с биопсийным материалом является макроскопическое описание столбиков тканей с последующим формированием патологоанатомического заключения. В мире приняты следующие диагнозы для оценки биоптатов ПЖ [6,7]:
- Аденокарцинома предстательной железы;
- Фокус, подозрительный в отношении аденокарциномы предстательной железы (атипическая мелко-ацинарная пролиферация);
- Простатическая интраэпители-альная неоплазия высокой степени;
- Нет данных за злокачественное образование.
В большинстве случаев злокачественные новообразования ПЖ представляют собой ацинарную аденокарциному. При формировании патологоанатомического заключения описывается длина каждого биоптата и процент протяженности опухоли в каждом из биоптатов; степень дифферен-цировки опухоли по системе градации Глисона; общее количество биоптатов с аденокарциномой; локализация опухоли, согласно схеме, предоставленной урологами; наличие опухоли в пери-простатической жировой ткани; наличие периневральной инвазии.
Протяженность опухолевой ткани в биоптатах подсчитывается в процентах. Расчет заключается в делении общей протяженности пораженной ткани биоптата на общую длину биоптата за исключением длины перипростатической ткани.
В биоптат ПЖ может попасть перипростатическая ткань и ткань семенных пузырьков, что позволяет патологу диагностировать экстрапрос-тическую инвазию и инвазию в семенные пузырьки.
Степень дифференцировки аденокарциномы ПЖ производится согласно шкале Глисона. Основным принципом данной шкалы является просмотр биоптатов под малым увеличением (объективы 4х-10х) с преимущественной оценкой тканевой атипии [11-15]. За редким исключением РПЖ имеет неоднородную структуру [12,13,16,17]. Поэтому для того, чтобы подсчитать показатель Глисона при исследовании ткани ПЖ после биопсии суммируют две наиболее высоких градации, с указанием их процентного соотношения. Полученное число баллов служит важным прогностическим критерием, позволяющим предположить более быстрое прогрессирование заболевания, метастази-рование и снижение выживаемости.
Классификация Глисона остается стандартным подходом в гистологической градации аденокарциномы предстательной железы. Изменения, внесенные в классификацию Глисона в 2004 году, так же учтены и в классификации 2016 года. Существенным дополнением классификации 2016 года явилась рекомендация указывать процент 4 балла в случае суммы баллов 7, а так же введены так называемые прогностические группы.
В 2014 году, международное общество уропатологов (ISUP) модифицировало классификацию Глисона. Основные выводы следующие:
- решетчатые (крибриформные) структуры должны быть отнесены к баллу 4;
- железы с гломеруляциями должны быть отнесены к баллу 4;
- оценка муцинозной аденокарциномы ПЖ должна быть основана на ее основном характере роста.
В прошлом в некоторых случаях крибриформная аденокарцинома была оценена как балл 3, в соответствии с классификацией ВОЗ 2004 года редкие решетчатые железы могли быть оценены как балл 3. Однако последние данные показали, что крибриформная аденокарцинома является независимым фактором прогноза биохимического рецидива после радикальной простатэктомии (РПЭ), метастазирования после РПЭ и раковоспецифической выживаемости [18-20]. Поэтому все крибриформные структуры принято относить к 4 баллу. Еще одним изменением в классификации ВОЗ 2004 года является то, что плохо сформированные железы относятся к баллу 4. В настоящее время балл 4 включает: решетчатые железы, сливающие железы, плохо сформированные железы, железы с гломеруляциями. В рекомендациях 2016 года требуется указывать процент балла 4 при сумме баллов 7 в патологических ответах биопсии ПЖ и в патологических заключениях после РПЭ, в рекомендациях ВОЗ 2004 года, патологические заключения, указывающие балл 4/5, не часто встречались в клинической практике. Указание процента 4 балла может иметь решающее значение в планировании дальнейшего лечения. Так, например, некоторым пациентам с суммой баллов 3+4=7, при низком проценте 4 балла, может быть предложено активное наблюдение. Множество данных, позволяет предположить, что указание процента аденокарциномы таких высоких грейдов как 4 и 5, является важным прогностическим показателем. Однако, метод, который необходимо использовать для определения процентного соотношения, не уточняется.
Недавно был разработан перечень прогностических групп. На конгрессе международного общества уропатологов в 2014 году состоялся консенсус с участием широкого круга патологов и клиницистов, на котором была предложен новый взгляд на использование шкалы Глисона, подразумевающий создание прогностических групп от 1 до 5 на основании суммы баллов градации Глисона и прогноза для пациента:
Группа 1: Сумма баллов, согласно градации Глисона 3+3=6;
Группа 2: Сумма баллов, согласно градации Глисона 3+4=7;
Группа 3: Сумма баллов, согласно градации Глисона 4+3=7;
Группа 4: Сумма баллов, согласно градации Глисона 4+4=8, 3+5=8, 5+3=8;
Группа 5: Сумма баллов, согласно градации Глисона 9-10.
Есть несколько оснований для создания групп: сумма баллов 2 и 5 не используется или используется крайне редко, баллы шкалы Глисона были сформированы достаточно давно с использованием других механизмов, определяющих факторы прогноза. Кроме того, группа 1 обозначает для клинициста и пациента, что сумма баллов 6 является минимально возможной из 6 групп, а не указывает на некую среднюю сумму баллов от 1 до 10. Данное положение является критическим и информирует все заинтересованные стороны, о том, что аденокарцинома ПЖ балл 1 имеет благоприятный прогноз. Таким образом, пациенты из группы 1 с учетом клинических данных (уровень ПСА сыворотки крови, клиническая стадия заболевания, количество опухоли в ткани всех биоптатов ткани ПЖ) могут быть кандидатами на активное наблюдение. Прогностическая значимость пяти групп была подтверждена в крупном исследовании с участием множества институтов. Было исследовано более 20 000 случаев РПЭ, более 16 000 случаев тонкоигольных биопсий ПЖ и более 5000 биопсий с последующей лучевой терапией [21]. Интересно так же, что существуют геномные корреляции в поддержку формирования данной групповой оценки прогноза заболевания [22]. В связи с чем, согласно рекомендациям ВОЗ 2016 г., прогностический балл в патологоанатомическом ответе необходимо указывать наряду с общепринятой градацией по шкале Глисона с учетом ее изменений в 2014 году.
ВЫВОДЫ
1. При выявлении атипической мелкоацинарной пролиферации рекомендовано выполнение повторной биопсии.
2. Сумма баллов по системе градации Глисона 2-4 всегда является заниженной и некорректной. Под этим диагнозом может скрываться аденокарцинома с суммой баллов 6 или аденоз (атипическая аденоматозная гиперплазия). Сумма баллов 5, практически всегда является заниженной и будет выше после радикальной простатэктомии.
3. При нескольких позитивных биоптатах, содержащих различные степени дифференцировки по системе градации Глисона, суммируются две наиболее высокие градации.
4. Средняя длина столбика ПЖ на микропрепарате должна составлять не менее 1 см.
5. Частота диагностики атипической мелкоацинарной пролиферации не должна превышать 5%.
6. Рекомендовано выполнять забор биопсийных столбиков согласно карте биопсии ПЖ, когда каждый биопсийный столбик погружается в отдельный маркированный контейнер.
7. Рекомендовано размещать на одном микропрепарате не более одного столбика ткани.
8. В патологоанатомическом ответе необходимо указывать прогностический балл наряду с общепринятой градацией по шкале Глисона с учетом ее изменений в 2014 году.
Работа выполнена при поддержке РНФ, соглашение № 14-15-01120.
ЛИТЕРАТУРА
1. Rogatsch H, Moser P, Volgger H. Diagnostic effect of an improved preembedding method of prostate needle biopsy specimens. Hum Pathol 2000; 31(9):1102-1107.
2. Delahunt B, Nacey JN. Broadsheet number 45: thin core biopsyof prostate. Pathol 1998; 30:247-256.
3. Ohori M, Kattan M, Scardinio PT. Radical Prostatectomy for carcinoma of the prostate. Mod Pathol 2004; 17(3):349-359.
4. Srigley JR, Jones B, Kapusta L. The effect of specimen submission protocols on the detection rate of histologic abnormalities in sextant prostate biopsies (abstract). Mod Pathol 2001; 14:123.
5. Lane RB, Lane CG, Mangold KA. Needle biopsy of prostate. What constitutes adequate histologic sampling? Arch Pathol Lab Med 1998; 122:833-835.
6. Murthy WM, Ramsey J, Soloway MS. A better nuclear fixative for diagnostic bladder and prostate biopsies. J Urol Pathol 1993; 1:79-87.
7. Boccon-Gibod L, van der Kwast TH, Montironi R, Boccon-Gibod L, Bono A. Handling and reporting of prostate biopsies. Eur Urol 2004; 46(2):177-181.
8. Reyes AJ, Humphrey PA. Diagnostic effect of complete histologic sampling of prostate needle biopsy specimens. Am J Clin Pathol 1998; 109:416-422.
9. Kao J, Upton M, Zhang P, Rosen S. Individual prostate biopsy core (Bc) embedding facilitates maximal tissue representation. J Urol 2002; 168(2):496-499.
10. Brat DJ, Wills ML, Lecksell KL, Epstein JI. How often are diagnostic feartures missed less extensive sampling of prostate needle biopsy specimens? Am J Surg Pathol 1999; 23:257-262.
11. Humphrey P. A. Prostate pathology. Chicago. 2007, 556 p.
12. Coard KS, Freeman VL. Gleason grading of prostate cancer: : level of concordance between pathologists at the University Hospital of the West Indies. Am J Clin Pathol 2004; 122:373-376.
13. Gleason DF. Histologic grading of prostate cancer: a perspective. Hum Pathol 1992; 23:273-279.
14. Cangiano TG, Litwin MS, Naitoh J, Dorey F, deKernion JB. Intraoperative frozen section monitoring of nerve sparing radical retropubic prostatectomy. J Urol 1999; 162(3 Pt 1):655-658.
15. Epstein JI. Pathologic assessment of the surgical specimen. Urol Clin North Am 2001; 28(3):567-594.
16. Humphrey PA. Gleason grading and prognostic factors in carcinoma of the prostate. Mod Pathol 2004; 17:292-306.
17. Gleason DF, Mellinger GT. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol 1974; 111 (1):59-64.
18. Kir G, Sarbay BC, Giimiij E, Topal CS. The association of the cribriform pattern with outcome for prostatic adenocarcinomas. Pathol Res Pract 2014;210(10):640-644. doi: 10.1016/j.prp.2014.06.002
19. Dong F, Yang P, Wang C, Wu S, Xiao Y, McDougal WS, et al. Architectural heterogeneity and cribriform pattern predict adverse clinical outcome for Gleason grade 4 prostatic adenocarcinoma. Am J Surg Pathol 2013; 37(12):1855-1861. doi: 10.1097/PAS.0b013e3182a02169.
20. Kweldam CF, Wildhagen MF, Steyerberg EW, Bangma CH, van der Kwast TH, van Leen-ders GJ. Cribriform growth is highly predictive for postoperative metastasis and disease-specific death in Gleason score 7 prostate cancer. Mod Pathol 2015; 28(3):457-464. doi: 10.1038/mod-pathol.2014.116.
21. Epstein JI, Zelefsky MJ, Sjoberg DD, Nelson JB, Egevad L, Magi-Galluzzi C, et al. A contemporary prostate cancer grading system: a validated alternative to the Gleason score. Eur Urol 2016; 69(3):428-435. doi: 10.1016/j.eururo.2015.06.046
22. Rubin MA, Girelli G, Demichelis F. Genomic correlates to the newly proposed grading prognostic groups for prostate cancer. Eur Urol 2016;69(4):557-560. doi: 10.1016/ j.eururo.2015.10.040.
Работа выполнена при поддержке РНФ, соглашение № 14-15-01120.
Источники: http://uroguru.com/diagnostika/prostata/rezultaty-biopsii-prostaty-norma.html, http://worldofoncology.com/materialy/vidy-raka/gistologicheskie-tipy-raka/rak-predstatelnoy-zhelezy-gistologicheskie-formy/, http://www.uroweb.ru/article/gistologicheskie_osobennosti_raka_predstatelnoy_gelezi










































